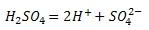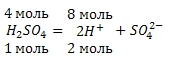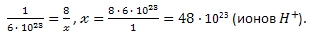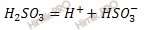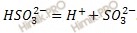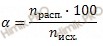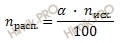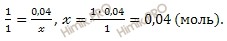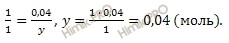Записать уравнения диссоциации серная кислота по ступеням
§ 4. Диссоциация кислот, щелочей и солей
Электролитическую диссоциацию электролитов выражают уравнениями, как и любые другие химические реакции.
Кислоты диссоциируют на ионы водорода и ионы кислотного остатка, например;
Щелочи диссоциируют на ионы металла и ионы гидроксила, например:
Соли диссоциируют на ионы металла и ионы кислотного остатка, например:
Разберем один из приведенных примеров — электролитическую диссоциацию серной кислоты. Уравнение читается так: каждая молекула серной кислоты диссоциирует на два положительно заряженных иона водорода и ион «эс-о-четыре», несущий два отрицательных заряда. Заметим, что ионы водорода, в отличие от атомов водорода, не соединяются попарно: они не могут не только связаться друг с другом, но даже приблизиться друг к другу, так как заряжены одноименно, а одноименно заряженные тела отталкиваются.
Уравнение изображает диссоциацию серной кислоты суммарно. По существу же диссоциация многоосновных кислот является ступенчатой. Ионы водорода отщепляются от молекул кислоты не одновременно, а последовательно, один за другим:
Так как молекула или кристалл любого вещества в целом электронейтральны, общая сумма зарядов положительно заряженных ионов, образующихся при диссоциации, всегда равна общей сумме зарядов отрицательно заряженных ионов.
- Что показывают уравнения: a) NaCl = Na + + Cl — ; б) Na + + Cl — = NaCl? А Как осуществить ту и другую реакцию в домашних условиях?
- Напишите уравнение электролитической диссоциации в растворах следующих веществ: а) иодистоводородной кислоты, б) селеновой кислоты H2SeO4, в) гидроокиси лития, г) гидроокиси бария Ва(ОН)2, д) нитрата меди (II) Cu(NO3)2, e) сульфата железа (III), ж) сульфида натрия, з) бисульфата натрия NaHSO4 (если известно, что его раствор окрашивает лакмус в красный цвет). Проверьте, одинаковы ли суммы зарядов положительно и отрицательно заряженных ионов. Прочтите первые два уравнения.
- Напишите уравнения трех последовательных ступеней диссоциации фосфорной кислоты Н3РO4. Проверьте, одинаковы ли суммы зарядов положительно и отрицательно заряженных ионов.
Источник
Химик.ПРО – решение задач по химии бесплатно
Сколько ионов водорода и сколько молей ионов водорода образуется при полной диссоциации 4 моль серной кислоты (H2SO4)?
Запишем уравнение диссоциации серной кислоты:
Из условия задачи и уравнения диссоциации серной кислоты следует, что 4 моль серной кислоты (H2SO4) образует 8 моль ионов водорода (H + ):
Учитывая, что в 1 моль вещества содержится 6 ∙ 10 23 частиц (молекул, ионов), можно найти какое число ионов содержится в 8 моль ионов H + .
Число 6 ∙ 10 23 называется постоянной Авогадро и обозначается NA. NA указывает число структурных единиц в одном моле вещества:
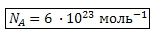
в 1 моль вещества содержится 6 ∙ 10 23 ионов
в 8 моль вещества содержится 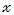
Ответ: 48 ∙ 10 23 ионов H + , 8 моль ионов водорода.
Источник
Химик.ПРО – решение задач по химии бесплатно
Вычислите суммарное число моль ионов водорода (H + ) и гидросульфит-ионов (HSO3 — ), которые образуются в растворе, содержащем 0,1 моль сернистой кислоты (H2SO3). Степень диссоциации сернистой кислоты (H2SO3) в растворе по первой ступени равна 40 % (диссоциацией по второй ступени пренебречь).
Запишем уравнение диссоциации сернистой кислоты (H2SO3) по первой и второй ступени:
Первая ступень:
Учитывая, что степень диссоциации сернистой кислоты (H2SO3) в растворе по первой ступени равна 40 %, я предлагаю решить задачу, используя формулу расчета степени электролитической диссоциации:
Откуда выразим число моль электролита, распавшихся в растворе на ионы:
n (расп.) = 40 ∙ 0,1 / 100 = 0,04 (моль).
По уравнению диссоциации вычислим, сколько моль водорода (H + )и гидросульфит-ионов (HSO3 — ) образуется при диссоциации 0,04 моль сернистой кислоты (H2SO3):
при диссоциации 1 моль сернистой кислоты образуется 1 моль ионов H +
при диссоциации 4 моль сернистой кислоты образуется 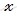
при диссоциации 1 моль сернистой кислоты образуется 1 моль HSO3 — ионов
при диссоциации 0,04 моль сернистой кислоты образуется y HSO3 — ионов
В результате получаем, что суммарное число моль ионов водорода (H + ) и сульфит-ионов (HSO3 — ) равно 0,08 моль (0,04 моль + 0,04 моль).
Ответ:
суммарное число моль ионов водорода и гидросульфит-ионов равно 0,08 моль.
Источник
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Источник
Записать уравнения диссоциации серная кислота по ступеням
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
I. Электролитическая диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H + )
1. Электролитическая диссоциация одноосновных кислот
Рис. Строение молекул хлороводорода и воды
Рассмотри процесс электролитической диссоциации кислот. Молекулы кислот образованы ковалентной полярной связью, а значит, кислоты состоят не из ионов, а из молекул.
Возникает вопрос – как же тогда кислота диссоциирует, т. е как в кислотах образуются свободные заряженные частицы? Оказывается, ионы образуются в растворах кислот именно при растворении.
Рассмотрим процесс электролитической диссоциации хлороводорода в воде, но для этого запишем строение молекул хлороводорода и воды.
Обе молекулы образованы ковалентной полярной связью. Электронная плотность в молекуле хлороводорода смещена к атому хлора, а в молекуле воды – к атому кислорода. Молекула воды способна оторвать катион водорода от молекулы хлороводорода, при этом образуется катион гидроксония Н3О + .
В уравнении реакции электролитической диссоциации не всегда учитывают образование катиона гидроксония – обычно говорят, что образуется катион водорода.
Тогда уравнение диссоциации хлороводорода выглядит так:
HCl⇄H + + Cl —
При диссоциации одного моля хлороводорода образуются один моль катиона водорода и один моль хлорид — анионов.
2. Электролитическя диссоциация многоосновных кислот
Многоосновные кислоты диссоциируют ступенчато.
Рассмотри процесс электролитической диссоциации серной кислоты. Серная кислота диссоциирует ступенчато, в две стадии.
I–я стадия диссоциации
На первой стадии отрывается один катион водорода и образуется гидросульфат-анион.
II — я стадия диссоциации
На второй стадии происходит дальнейшая диссоциация гидросульфат — анионов.
Эта стадия является обратимой, то есть, образующиеся сульфат — ионы могут присоединять к себе катионы водорода и превращаться в гидросульфат — анионы. Это показано знаком обратимости.
Существуют кислоты, которые даже на первой стадии диссоциируют не полностью – такие кислоты являются слабыми. Например, угольная кислота Н2СО3.
Н3РО4 ↔ Н + + Н2РО4 — (первая ступень) – дигидроортофосфат ион
Н2РО — 4 ↔ Н + + НРO4 2- (вторая ступень) – гидроортофосфат ион
НРО 2- 4 ↔ Н + + PО4 З- (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей.
II. Электролитическая диссоциация оснований
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH — )
Диссоциация амфотерных оснований (амфолитов)
Щёлочи – это основания, растворимые в воде
Это основания щелочных и щелочноземельных металлов :
LiOH, NaОН, КОН, Rb ОН, С s ОН, Fr ОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, R а(ОН)2, а также NН4ОН
Амфолиты — это электролиты, которые при диссоциации одновременно образуют катионы водорода (H + ) и гидроксид-ионы ( OH — )
Примеры уравнений диссоциации щелочей
Многокислотные основания диссоциируют ступенчато:
Ba(ОН)2 -> Bа(ОН) + + OH — (первая ступень)
Ba(OH) + ↔ Ba 2+ +OH — (вторая ступень)
Примеры уравнений диссоциации амфолитов
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением:
Нерастворимые в воде основания практически не подвергаются электролитической диссоциации, так как в воде они практически нерастворимы, а при нагревании – разлагаются, так что расплав их получить не удается.
III. Электролитическая диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH + 4) и анионы кислотных остатков.
Например, диссоциация средних солей :
Кислые же и основные соли диссоциируют ступенчато:
Диссоциация кислых солей
Диссоциация основных солей
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
Mg(OH)Cl -> Mg(OH) + + Cl —
Mg (OH) + ↔ Mg 2+ + OH —
IV. Тренажеры
Тренажёр №2 — Катионы и анионы
Интерактивное задание LearningApps.org по теме: “Химические свойства растворов кислот»
V. Памятки
Памятка – Определение солей
VI. Задания для закрепления
Задание №1. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
Задание №2. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ: Ca(OH)2, Na2CO3, Na3PO4, HNO3, KOH, Ba(OH)2, H2SO3, Ca(NO3)2, Ca3(PO4)2, H2S, NaOH, HBr
Источник