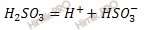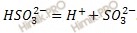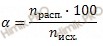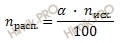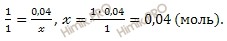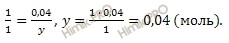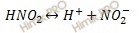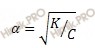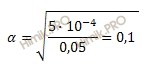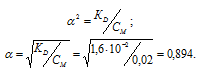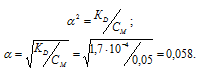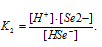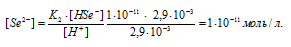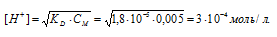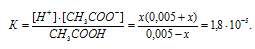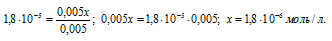Химик.ПРО – решение задач по химии бесплатно
Вычислите суммарное число моль ионов водорода (H + ) и гидросульфит-ионов (HSO3 — ), которые образуются в растворе, содержащем 0,1 моль сернистой кислоты (H2SO3). Степень диссоциации сернистой кислоты (H2SO3) в растворе по первой ступени равна 40 % (диссоциацией по второй ступени пренебречь).
Запишем уравнение диссоциации сернистой кислоты (H2SO3) по первой и второй ступени:
Первая ступень:
Учитывая, что степень диссоциации сернистой кислоты (H2SO3) в растворе по первой ступени равна 40 %, я предлагаю решить задачу, используя формулу расчета степени электролитической диссоциации:
Откуда выразим число моль электролита, распавшихся в растворе на ионы:
n (расп.) = 40 ∙ 0,1 / 100 = 0,04 (моль).
По уравнению диссоциации вычислим, сколько моль водорода (H + )и гидросульфит-ионов (HSO3 — ) образуется при диссоциации 0,04 моль сернистой кислоты (H2SO3):
при диссоциации 1 моль сернистой кислоты образуется 1 моль ионов H +
при диссоциации 4 моль сернистой кислоты образуется 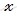
при диссоциации 1 моль сернистой кислоты образуется 1 моль HSO3 — ионов
при диссоциации 0,04 моль сернистой кислоты образуется y HSO3 — ионов
В результате получаем, что суммарное число моль ионов водорода (H + ) и сульфит-ионов (HSO3 — ) равно 0,08 моль (0,04 моль + 0,04 моль).
Ответ:
суммарное число моль ионов водорода и гидросульфит-ионов равно 0,08 моль.
Источник
Сернистая кислота: получение и химические свойства
Сернистая кислота H2SO3 – это двухосновная кислородсодержащая кислота. При нормальных условиях — неустойчивое вещество, которое распадается на диоксид серы и воду.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.

Химические свойства
1. Сернистая кислота H2SO3 в водном растворе – двухосновная кислота средней силы. Частично диссоциирует по двум ступеням:
HSO3 – ↔ SO3 2– + H +
2. Сернистая кислота самопроизвольно распадается на диоксид серы и воду:
3. Сернистая кислота взаимодействует с сильными основаниями и их оксидами.
Например , сернистая кислота реагирует с гидроксидами натрия и калия:
4. Наиболее ярко выражены восстановительные свойства сернистой кислоты. При взаимодействии с окислителями степень окисления серы повышается.
Например , сернистая кислота обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистую:
Озон также окисляет сернистую кислоту:
Качественная реакция на сернистую кислоту – обесцвечивание раствора перманганата калия:
5. В присутствии сильных восстановителей сернистая кислота может проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистая кислота восстанавливается до молекулярной серы:
Источник
Химик.ПРО – решение задач по химии бесплатно
Константа диссоциации азотистой кислоты (HNO2) составляет 5 ∙ 10 -4 . Вычислить степень диссоциации (α) и равновесную концентрацию ионов водорода ([H + ]) для 0,05 раствора этой кислоты.
I способ решения (II способ)
Запишем уравнение диссоциации азотистой кислоты:
Данную задачу я предлагаю решать через закон разбавления Оствальда в его приближенном варианте, используя формулу:
α – степень диссоциации;
K – константа диссоциации;
C– общая концентрация электролита.
Хочу обратить ваше внимание на то, что данная формула может быть использована для вычисления степени диссоциации (α ) и равновесной концентрации ионов водорода [H + ] лишь при условии, что концентрация слабого электролита в 100 или более раз больше его константы диссоциации (K). В решенной задаче отношение C / K = 100.
Константа диссоциации характеризует способность электролита диссоциировать на ионы.
Найдем степень диссоциации азотистой кислоты, подставив известные значения из условия задачи в формулу:
что соответствует 10 %.
Найдем равновесную концентрацию ионов водорода:
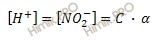
[H + ] = 0,05 ∙ 0,1 = 0,005 (моль/л).
Ответ: степень диссоциации азотистой кислоты = 10 %; равновесная концентрация ионов водорода = 0,005 моль/л.
Источник
Вещества диссоциируют по ступеням сернистая кислота азотистая кислота
4.3 РАСТВОРЫ ЭЛЕКТРОЛИТОВ
4.3.1 Электролитическая диссоциация
Электролиты – вещества, которые при растворении подвергаются диссоциации на ионы. В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда. Например, при растворении в воде уксусная кислота диссоциирует на ион водорода и ацетат-ион:
Необходимым условием, определяющим возможность процесса электролитической диссоциации, является наличие в растворяемом веществе ионных * или полярных связей *, а также достаточная полярность * самого растворителя *. Количественная оценка процесса электролитической диссоциации дается двумя величинами: степенью диссоциации α и константой диссоциации K.
Степенью диссоциации (α) электролита называется отношение числа его молекул, распавшихся на ионы, к общему числу молекул электролита в растворе, т. е. . Так, если C=0,1 моль/л, а концентрация диссоциированной части вещества Сд=0,001 моль/л, то для растворенного вещества α=0,001/0,1=0,01, или α=1%. Степень электролитической диссоциации зависит как от природы растворенного вещества, так и от концентрации раствора, увеличиваясь с его разбавлением.
Электролиты можно разделить на две большие группы: сильные и слабые. Сильные электролиты диссоциируют практически полностью. К сильным электролитам относятся, например, H2SO4[43], HCl[44], HNO3[45], H3PO4[46], HClO3[47], HClO48[4], KOH[49], а также хорошо растворимые соли: NaCl[50], KBr[51], NH4NO3[52] и др. Для слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами. К слабым электролитам относятся плохо растворимые соли (см. таблицу растворимости), вода и большинство органических кислот (например, уксусная CH3COOH, муравьиная HCOOH), а также неорганические соединения: H2CO3[53], H2S[54], HCN[55], H2SiO3[56], H2SO3[57], HNO2[58], HClO[59], HCNO[60], NH4OH[61] и др.
Константа равновесия для процесса диссоциации называется константой диссоциации (K). В общем случае для электролита, диссоциирующего на два иона:
Для приведенного выше процесса диссоциации уксусной кислоты:
Если обозначить концентрацию электролита[62], распадающегося на два иона, через C, то
[A + ] = [B – ] = αC; [AB] = C(1–α);
Это уравнение соответствует закону разбавления Оствальда. Если электролит слабый, и диссоциация очень мала (α 2 C; .
Таким образом, степень диссоциации возрастает с разбавлением раствора.
Многоосновные кислоты, а также основания многовалентных металлов диссоциируют ступенчато. Например:
Первое равновесие – диссоциация по первой ступени – характеризуется константой
Для диссоциации по второй ступени:
В случае угольной кислоты константы диссоциации имеют следующие значения: KI = 4,3·10 –7 , KII = 5,6·10 –11 . Для ступенчатой диссоциации всегда KI>KII>KIII>. т.к. энергия, которую необходимо затратить для отрыва иона, минимальна при отрыве его от нейтральной молекулы.
4.3.2 Произведение растворимости. Водородный показатель
Растворение твердых электролитов* прекращается, когда образуется насыщенный раствор, в котором устанавливается гетерогенное равновесие между твердой фазой и перешедшими в раствор ионами. Например:
В выражение константы этого гетерогенного равновесия не входит концентрация твердой фазы (см. особенности закона действия масс для гетерогенных процессов):
В насыщенном растворе твердого электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Она называется произведением растворимости.
Если молекула электролита содержит несколько одинаковых ионов, то концентрации этих ионов, согласно закону действия масс *, должны быть возведены в соответствующие степени. Например:
Зная произведения растворимости, можно решать вопросы, связанные с образованием или растворением осадков при химических реакциях. Например, пусть диссоциация соли АВ происходит на два иона:
Обозначив растворимость через s (моль/л), получим [A + ]=[B – ]=s, ПР=[A + ][B – ]=s 2 . На практике чаще возникает обратная задача определения растворимости. Для соли, диссоциирующей на два иона, . Значения ПР можно найти в химических справочниках. Например, ПР(AgCl)=1,8·10 –10 , ПР(AgBr)=6·10 –13 , ПР(BaSO4)=1,1·10 –10 , ПР(HgS)=10 –52 . Если соль имеет общую формулу AB2, то она диссоциирует по уравнению:
Источник
Расчет степени диссоциации сернистой кислоты и других кислот
Задача 511.
Вычислить концентрацию ионов [H + ] в 0,02М растворе сернистой кислоты. Диссоциацией кислоты во второй ступени пренебречь.
Решение:
K1(H2SO3) = 1,6 . 10 -2 .
Рассчитаем степень диссоциации кислоты по уравнению: KD = CM . 
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты, 
Концентрация иона водорода будет равна произведению степени диссоциации на концентрацию кислоты:
[H + ] = 
Ответ: 0,018 моль/л.
Задача 512. ( 3 . 10 -4 )/(1,8 . 10 -6 ) = 167
Вычислить концентрацию ионов [H + ], [HSe — ] и [Se 2- ] в 0,05 М растворе H2Se.
Решение:
Уравнение диссоциации H2Se имеет вид:
Константа диссоциации H2Se равна 1,7 . 10 4 . Рассчитаем степень диссоциации кислоты по уравнению: KD = CM . 
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты, 
Концентрация иона водорода будет равна произведению степени диссоциации на концентрацию кислоты:
[H + ] = [HSe — ] = 
Уравнение диссоциации H2Se по второй ступени имеет вид:
Тогда выражение константы диссоциации иона HSe — будет иметь вид:
Ответ: [H + ] = [HSe — ] = 2,9 . 10 -3 ; [Se 2- ] = 1 . 10 -11 .
Задача 513.
Во сколько раз уменьшится концентрация ионов водорода, если к 1 л 0,005 М раствора уксусной кислоты добавить 0,05 моля ацетата натрия?
Решение:
Исходную концентрацию ионов H + в растворе (до добавления ацетата натрия( рассчитаем по уравнению:
Концентрацию ионов водорода в растворе после добавления соли обозначим через x. Тогда, концентрация недиссоциированных молекул кислоты будет равна (0,005 –x). Концентрация ацетат-ионов будет слагаться из двух величин: из концентрации, создаваемой диссоциацией молекул кислоты (CH3COOH ⇔ CH3COO — + H + ), и концентрации, обусловленной диссоциацией в растворе соли (CH3COONa ⇔ CH3COO — + Na + ). Первая из этих величин равна x, а вторая – 0,005 моль/л; общая концентрация ионов CH3COO — равна, следовательно, (0,005 + x) моль/л. Подставив значения концентраций в выражение для константы диссоциации уксусной кислоты, получим:
Так как в присутствии одноимённых ионов CH3COO — диссоциация уксусной кислоты подавляется, то степень её диссоциации мала и значением x можно пренебречь. Тогда последнее выражение упростится, получим:
При сравнении исходной концентрации ионов водорода с рассчитанной, находим, что прибавление к раствору кислоты соли вызвало уменьшение концентрации ионов водорода в 167 раз:
( 3 . 10 -4 )/(1,8 . 10 -6 ) = 167
Источник