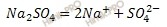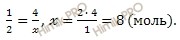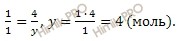Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Источник
Химик.ПРО – решение задач по химии бесплатно
Вычислите суммарное число моль ионов натрия (Na + ) и сульфат-ионов (SO4 2- ), которые образуются в растворе сульфата натрия (Na2SO4), содержащем 4 моль сульфата натрия (Na2SO4).
Запишем уравнение диссоциации раствора сульфата натрия (Na2SO4), учитывая, что соли – сильные электролиты:
По уравнению диссоциации вычислим, сколько моль ионов натрия (Na + ) и сульфат-ионов (SO4 2- ) образуется в растворе сульфата натрия (Na2SO4), содержащем при полной диссоциации 4 моль сульфата натрия (Na2SO4):
при диссоциации 1 моль сульфата натрия образуется 2 моль ионов Na +
при диссоциации 4 моль сульфата натрия образуется 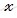
при диссоциации 1 моль сульфата натрия образуется 1 моль SO4 2 ионов
при диссоциации 4 моль сульфата натрия образуется y моль SO4 2 ионов
Суммарное число моль ионов натрия (Na + ) и сульфат-ионов (SO4 2- ) в растворе сульфата натрия (Na2SO4), равно 12 моль (8 + 4).
Источник
Люди,помогите, кто чем сможет, не то мне 2 в году. сделать химию:
серная кислота — сильный электролит, 2-основная кислота, диссоциирует ступенчато:
H2SO4 = H+ + HSO4 —
HSO4 — = H+ + SO4 2-
соляная кислота — сильный электролит:
HCl = H+ + Cl-
гидроксид железа (II) — практически нерастворим в воде, поэтому диссоциирует очень слабо, главным образом, по 1 ступени; т. к. основание 2-кислотное, то диссоциация ступенчатая:
Fe(OH)2 = Fe(OH)+ + OH-
Fe(OH)+ = Fe2+ + OH-
сульфат натрия — сильный электролит, как все средние соли, диссоциирует сразу:
Na2SO4 = 2Na+ + SO4 2-
гидроксид лития — сильный электролит (как и все щелочи) :
LiOH = Li+ + OH-
азотная кислота — сильный электролит:
HNO3 = H+ + NO3 —
хлорид железа (III) — сильный электролит:
FeCl3 = Fe3+ + 3Cl-
силикат калия — сильный электролит:
K2SiO3 = 2K+ + SiO3 2-
гидроксид натрия — сильный электролит:
NaOH = Na+ + OH-
фосфат лития — сильный электролит:
Li3PO4 = 3Li+ + PO4 3-
карбонат натрия — сильный электролит:
Na2CO3 = 2Na+ + CO3 2-
хлорид бария — сильный электролит:
BaCl2 = Ba2+ + 2Cl-
сульфит натрия — сильный электролит:
Na2SO3 = 2Na+ + SO3 2-
нитрат алюминия — сильный электролит:
Al(NO3)3 = Al3+ + 3NO3 —
гидроксид алюминия — амфотерный гидроксид, нерастворим в воде, диссоциация незначительная, ступенчатая, происходит, главным образом, по первой ступени. Поскольку гидроксид амфотерен, он в кислой среде диссоциирует как основание, а в щелочной среде — как кислота:
в кислой среде:
Al(OH)3 = Al(OH)2 + +OH-
Al(OH)2 + = Al(OH)+ + OH-
Al(OH)+ = Al3+ + OH-
в щелочной среде:
H3AlO3 = H2AlO3- + H+
H2AlO3- = HAlO3- + H+
HAlO3- = AlO3- + H+
(правда, в щелочной среде образуются обычно комплексные соединения алюминия — типа Na[Al(OH)4])
P.S.: гидроксиды железа и алюминия — слабые электролиты, поэтому в уравнениях реакций ионного обмена записываются всегда в молекулярном виде, т. к. выпадают в осадок. Однако, незначительная диссоциация этих веществ всё же имеет место, и если речь идет, допустим, о нахождении константы диссоциации или произведении растворимости этих веществ, то диссоциация их, конечно, учитывается и записываются приведенные выше уравнения. Т. к. константа диссоциации по второй и третьей ступеням значительно слабее (на несколько порядков) , чем по первой ступени, то обычно записывают уравнение диссоциации их только по первой ступени.
моя любимаятема по химии, если вы прочитает-пймете как делть. очень много псат, простите, ухожу спать.
ну вот доустим-хлорид бария-BaCl 2 ( p ) + Na 2SO 4 ( p ) → BaSO 4 ( к ) ↓ +2 NaCl ( p )
BaCl + H SO = BaSO + 2HCl
Источник
Диссоциация кислот, оснований, амфотерных гидроксидов и солей в водных растворах
Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы водорода Н + . Составим уравнение электролитической диссоциации сильных кислот: а) одноосновной азотной кислоты HNО3 и б) двухосновной серной кислоты H2SO4:
Число ступеней диссоциации зависит от основности слабой кислоты Нх(Ас), где х — основность кислоты.
Пример: Составим уравнения электролитической диссоциации слабой двухосновной угольной кислоты Н2СО3.
Первая ступень диссоциации (отщепление одного иона водорода Н + ):
Константа диссоциации по первой ступени:
Вторая ступень диссоциации (отщепление иона водорода Н + от сложного иона НСО3 — ):
Растворы кислот имеют некоторые общие свойства, которые, согласно теории электролитической диссоциации, объясняются присутствием в их растворах гидратированных ионов водорода Н + (Н3О + ).
Основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН — .
Составим уравнение электролитической диссоциации однокислотного основания гидроксида калия КОН:
Сильное двухкислотное основание Ca(OH)2 диссоциирует так:
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у, где у — кислотность основания.
Составим уравнения электролитической диссоциации слабого двухкислотного основания — гидроксида железа (II) Fe(OH)2.
Первая ступень диссоциации (отщепляется один гидроксид-ион ОН — ):
Вторая ступень диссоциации (отщепляется гидроксид-ион ОН — от сложного катиона FeOH + ):
Основания имеют некоторые общие свойства. Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН — .
Каждая ступень диссоциации слабых многоосновных кислот и слабых многокислотных оснований характеризуется определенной константой диссоциации: K1, K2, K3, причем K1 > K2 > K3. Это объясняется тем, что энергия, которая необходима для отрыва иона Н + или ОН — от нейтральной молекулы кислоты или основания, минимальна. При диссоциации по следующей ступени энергия увеличивается, потому что отрыв ионов происходит от противоположно заряженных частиц.
Амфотерные гидроксиды могут реагировать и с кислотами, и с основаниями. Теория электролитической диссоциации объясняет двойственные свойства амфотерных гидроксидов.
Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н + и гидроксид-анионы ОН — , т. е. диссоциируют по типу кислоты и по типу основания.
К амфотерным гидроксидам относятся Ве(ОН)2, Zn(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3 и другие. Амфотерным электролитом является также вода Н2O.
В амфотерных гидроксидах диссоциация по типу кислот и по типу оснований происходит потому, что прочность химических связей между атомами металла и кислорода (Ме—О) и между атомами кислорода и водорода (О—Н) почти одинаковая. Поэтому в водном растворе эти связи разрываются одновременно, и амфотерные гидроксиды при диссоциации образуют катионы Н + и анионы ОН — .
Составим уравнение электролитической диссоциации гидроксида цинка Zn(OH)2 без учета ее ступенчатого характера:
Нормальные соли — сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
Составим уравнения электролитической диссоциации нормальных солей: а) карбоната калия K2CO3, б) сульфата алюминия Al2(SO4)3:
Кислые соли — сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.
Составим уравнения электролитической диссоциации кислой соли гидрокарбоната натрия NaHCО3.
Сложный анион НСО3 — (гидрокарбонат-ион) частично диссоциирует по уравнению:
Основные соли — электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы состоящие из атомов металла и гидроксогрупп ОН — .
Составим уравнение электролитической диссоциации основной соли Fe(OH)2Cl — дигидроксохлорида железа (III):
Сложный катион частично диссоциирует по уравнениям:
Для обеих ступеней диссоциации Fe(OH)2 + .
Источник