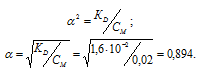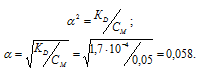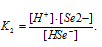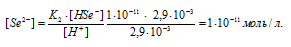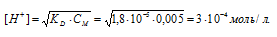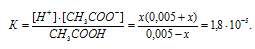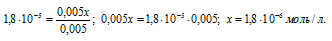Расчет степени диссоциации сернистой кислоты и других кислот
Задача 511.
Вычислить концентрацию ионов [H + ] в 0,02М растворе сернистой кислоты. Диссоциацией кислоты во второй ступени пренебречь.
Решение:
K1(H2SO3) = 1,6 . 10 -2 .
Рассчитаем степень диссоциации кислоты по уравнению: KD = CM . 
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты, 
Концентрация иона водорода будет равна произведению степени диссоциации на концентрацию кислоты:
[H + ] = 
Ответ: 0,018 моль/л.
Задача 512. ( 3 . 10 -4 )/(1,8 . 10 -6 ) = 167
Вычислить концентрацию ионов [H + ], [HSe — ] и [Se 2- ] в 0,05 М растворе H2Se.
Решение:
Уравнение диссоциации H2Se имеет вид:
Константа диссоциации H2Se равна 1,7 . 10 4 . Рассчитаем степень диссоциации кислоты по уравнению: KD = CM . 
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты, 
Концентрация иона водорода будет равна произведению степени диссоциации на концентрацию кислоты:
[H + ] = [HSe — ] = 
Уравнение диссоциации H2Se по второй ступени имеет вид:
Тогда выражение константы диссоциации иона HSe — будет иметь вид:
Ответ: [H + ] = [HSe — ] = 2,9 . 10 -3 ; [Se 2- ] = 1 . 10 -11 .
Задача 513.
Во сколько раз уменьшится концентрация ионов водорода, если к 1 л 0,005 М раствора уксусной кислоты добавить 0,05 моля ацетата натрия?
Решение:
Исходную концентрацию ионов H + в растворе (до добавления ацетата натрия( рассчитаем по уравнению:
Концентрацию ионов водорода в растворе после добавления соли обозначим через x. Тогда, концентрация недиссоциированных молекул кислоты будет равна (0,005 –x). Концентрация ацетат-ионов будет слагаться из двух величин: из концентрации, создаваемой диссоциацией молекул кислоты (CH3COOH ⇔ CH3COO — + H + ), и концентрации, обусловленной диссоциацией в растворе соли (CH3COONa ⇔ CH3COO — + Na + ). Первая из этих величин равна x, а вторая – 0,005 моль/л; общая концентрация ионов CH3COO — равна, следовательно, (0,005 + x) моль/л. Подставив значения концентраций в выражение для константы диссоциации уксусной кислоты, получим:
Так как в присутствии одноимённых ионов CH3COO — диссоциация уксусной кислоты подавляется, то степень её диссоциации мала и значением x можно пренебречь. Тогда последнее выражение упростится, получим:
При сравнении исходной концентрации ионов водорода с рассчитанной, находим, что прибавление к раствору кислоты соли вызвало уменьшение концентрации ионов водорода в 167 раз:
( 3 . 10 -4 )/(1,8 . 10 -6 ) = 167
Источник
Сернистая кислота диссоциация сколько ступеней
§ 4. Диссоциация кислот, щелочей и солей
Электролитическую диссоциацию электролитов выражают уравнениями, как и любые другие химические реакции.
Кислоты диссоциируют на ионы водорода и ионы кислотного остатка, например;
Щелочи диссоциируют на ионы металла и ионы гидроксила, например:
Соли диссоциируют на ионы металла и ионы кислотного остатка, например:
Разберем один из приведенных примеров — электролитическую диссоциацию серной кислоты. Уравнение читается так: каждая молекула серной кислоты диссоциирует на два положительно заряженных иона водорода и ион «эс-о-четыре», несущий два отрицательных заряда. Заметим, что ионы водорода, в отличие от атомов водорода, не соединяются попарно: они не могут не только связаться друг с другом, но даже приблизиться друг к другу, так как заряжены одноименно, а одноименно заряженные тела отталкиваются.
Уравнение изображает диссоциацию серной кислоты суммарно. По существу же диссоциация многоосновных кислот является ступенчатой. Ионы водорода отщепляются от молекул кислоты не одновременно, а последовательно, один за другим:
Так как молекула или кристалл любого вещества в целом электронейтральны, общая сумма зарядов положительно заряженных ионов, образующихся при диссоциации, всегда равна общей сумме зарядов отрицательно заряженных ионов.
- Что показывают уравнения: a) NaCl = Na + + Cl — ; б) Na + + Cl — = NaCl? А Как осуществить ту и другую реакцию в домашних условиях?
- Напишите уравнение электролитической диссоциации в растворах следующих веществ: а) иодистоводородной кислоты, б) селеновой кислоты H2SeO4, в) гидроокиси лития, г) гидроокиси бария Ва(ОН)2, д) нитрата меди (II) Cu(NO3)2, e) сульфата железа (III), ж) сульфида натрия, з) бисульфата натрия NaHSO4 (если известно, что его раствор окрашивает лакмус в красный цвет). Проверьте, одинаковы ли суммы зарядов положительно и отрицательно заряженных ионов. Прочтите первые два уравнения.
- Напишите уравнения трех последовательных ступеней диссоциации фосфорной кислоты Н3РO4. Проверьте, одинаковы ли суммы зарядов положительно и отрицательно заряженных ионов.
Источник
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Источник
Сернистая кислота
Описание презентации по отдельным слайдам:
Описание слайда:
Сернистая кислота
Учитель химии МБОУ «Елховская СОШ» Альметьевского муниципального района Республики Татарстан Гафарова А.З
Описание слайда:
Цель урока:
Повторить и закрепить знания учащихся о свойствах кислотных оксидов и кислот.
Рассмотреть свойства соединения серы – сернистого газа и сернистой кислоты его солей.
Рассмотреть влияние сернистого газа на окружающую среду и здоровье человека.
уметь составлять уравнения реакций в молекулярном виде и с точки зрения окислительно — восстановительных процессов.
Нравственное и эстетическое воспитание учащихся к окружающей среде.
Описание слайда:
Получение оксидов
1. Горение веществ (Окисление кислородом)
а) простых веществ
Mg +O2=2MgO S+O2=SO2
б) сложных веществ
2H2S+3O2=2H2O+2SO2
2.Разложение сложных веществ
а) солей
СaCO3=CaO+CO2
б) оснований
Cu (OH)2=CuO+H2O
в) кислородсодержащих кислот
H2SO3=H2O+SO2
Описание слайда:
1)Сероводород горит на воздухе голубым пламенем при этом образуется сернистый газ или оксид серы(IV)
2H2S-2 + 3O2 → 2H2O + 2S+4O2↑
оксид серы (IV)
2) При сгорании ее на воздухе или в кислороде образуется оксид серы (IV) SО2 и частично оксид серы (VI) SO3:
S + O2 = SO2
оксид серы (IV)
Описание слайда:
Нахождение в природе
Описание слайда:
Химические свойства кислот
1. Изменяют окраску индикатора.
2.Реагируют с металлами в ряду активности до H2 (искл. HNO3 –азотная кислота)
Ме + КИСЛОТА =СОЛЬ + H2↑ (р. замещения)
3. С основными (амфотерными) оксидами
МехОу + КИСЛОТА= СОЛЬ + Н2О (р. обмена)
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O ( р. обмена)
5. Реагируют с солями слабых, летучих кислот — если образуется соль, выпадающая в осадок или выделяется газ: ( р. обмена)
Сила кислот убывает в ряду:
HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3 > H2S > H2SiO3 .
Каждая предыдущая кислота может вытеснить из соли последующую
6. Разложение кислородсодержащих кислот при нагревании
( искл. H2SO4 ; H3PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Описание слайда:
Уравнение диссоциации сернистой кислоты.
H2SО3 → H+ + HSО3 —
HSО3 — ↔ H+ + SО3 2-
Это кислота средний силы, существует только в водных растворах.
Она дает 2 типа солей:
HSО3 — SО3 2-
гидросульфиты сульфиты
Описание слайда:
Качественная реакция на сульфиты.
Взаимодействие соли с сильной кислотой, при этом выделяется газ с резким запахом
Na2SO3+H2SO4=Na2SO4+S02+H2O
2NaHSO3+H2SO4=Na2SO4+2SO2+2H2O
2HSO3-+2H+=2SO2+2H2O
Описание слайда:
Физиологическое действие на организм.
SO2 очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отек легких.
При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу береза и дуб, наименее — роза, сосна и ель.
Описание слайда:
Воздействие
на атмосферу.
Из-за образования в больших количествах в качестве отходов диоксид серы является одним из основных газов, загрязняющих атмосферу.
Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
Антропогенное загрязнение серой в два раза превосходит природное. Серный ангидрид образуется при постепенном окислении сернистого ангидрида кислородом воздуха с участием света. Конечным продуктом реакции является аэрозоль серной кислоты в воздухе, раствор в дождевой воде (в облаках). Выпадая с осадками, она подкисляет почву, обостряет заболевания дыхательных путей, скрыто угнетающе воздействует на здоровье человека. Выпадение аэрозоля серной кислоты из дымовых факелов химических предприятий чаще отмечается при низкой облачности и высокой влажности воздуха. Растения около таких предприятий обычно бывают густо усеяны мелкими некротическими пятнами, образовавшимися в местах оседания капель серной кислоты, что доказывает присутствие ее в окружающей среде в существенных количествах. Пирометаллургические предприятия цветной и чёрной металлургии, а также ТЭЦ ежегодно выбрасывают в атмосферу десятки миллионов тонн серного ангидрида.
Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, Европы, Китая, европейской части России и Украины. В южном полушарии содержание его значительно ниже.
Описание слайда:
§12
стр34 №5
составить уравнения реакций в ионном и сокращенном ионном виде.
Спасибо за урок.
Урок окончен.
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Источник