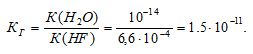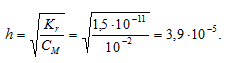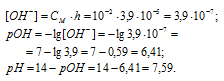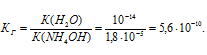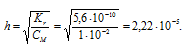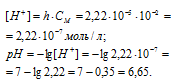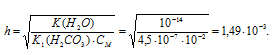Вычисление константы гидролиза, определение степени гидролиза соли
Задача 588.
Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(HF) = 6,6 . 10 -4 .
KF — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
Константа гидролиза соли определяется константой диссоциации образовавшейся кислоты HF и определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов OH — :
Ответ: КГ = 1,5 . 10 -11 ; h = 3,9 . 10 -5 ; pH = 7,59.
Задача 589.
Вычислить константу гидролиза хлорида аммония, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(NH4OH) = 1,8 . 10-5.
NH4Cl — соль слабого основания и сильной кислоты гидролизуется по катиону:
Константа гидролиза соли определяется константой диссоциации образовавшегося основания NH4OH и определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов H + :
Ответ: КГ = 5,6 . 10 -10 ; h = 2,4 . 10 -4 ; pH = 6,65.
Задача 590.
Определить рН 0,02 н. раствора соды Na2CO3, учитывая только первую ступень гидролиза.
Решение:
K1(H2CO3) = 4,5 . 10 -7 .
Na2CO3 — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
Здесь h — степень гидролиза соли, показывает долю гидролизованных ионов.
Теперь рассчитаем концентрацию образовавшихся ионов OH — :
Источник
Вычисление константы гидролиза, определение степени гидролиза соли
Задача 588.
Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(HF) = 6,6 . 10 -4 .
KF — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
Константа гидролиза соли определяется константой диссоциации образовавшейся кислоты HF и определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов OH — :
Ответ: КГ = 1,5 . 10 -11 ; h = 3,9 . 10 -5 ; pH = 7,59.
Задача 589.
Вычислить константу гидролиза хлорида аммония, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(NH4OH) = 1,8 . 10-5.
NH4Cl — соль слабого основания и сильной кислоты гидролизуется по катиону:
Константа гидролиза соли определяется константой диссоциации образовавшегося основания NH4OH и определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов H + :
Ответ: КГ = 5,6 . 10 -10 ; h = 2,4 . 10 -4 ; pH = 6,65.
Задача 590.
Определить рН 0,02 н. раствора соды Na2CO3, учитывая только первую ступень гидролиза.
Решение:
K1(H2CO3) = 4,5 . 10 -7 .
Na2CO3 — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
Здесь h — степень гидролиза соли, показывает долю гидролизованных ионов.
Теперь рассчитаем концентрацию образовавшихся ионов OH — :
Источник
Водородный показатель. Гидролиз солей
Федеральное агентство по образованию РФ
Новгородский Государственный Университет им. Ярослава Мудрого
Кафедра химии и экологии
Водородный показатель: Метод указ. / Сост. ; ; /
НовГУ им. Ярослава Мудрого, — Великий Новгород, 2012
Рассмотрены теоретические методы расчета и экспериментальные способы определения концентрации водородных ионов в растворах электролитов (рН растворов).
Методические указания предназначены для студентов всех специальностей, изучающих курс химии.
Утверждено на заседании кафедры химии и экологии НовГУ им. Ярослава Мудрого ……………….
Зав. кафедрой ХиЭ
Протекание различных химических процессов сильно зависит от реакции среды в растворе. Поэтому величина рН раствора является важнейшим показателем, который необходимо контролировать как при проведении реакций в научно-исследовательских лабораториях, так и в ходе разнообразных технологических процессов.
Настоящая лабораторная работа даёт возможность освоить способы измерения и методы расчёта рН в водных растворах электролитов. Перед её выполнением необходимо усвоить понятия: ионное произведение воды, характер среды, индикатор, гидролиз солей, водородный показатель.
Изучить методы расчета рН растворов электролитов.
Освоить методы определения рН растворов.
2. ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
2.1. Водородный показатель. Ионное произведение воды
Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН.
Водородный показатель численно равен отрицательному десятичному логарифму активности или концентрации ионов водорода, выраженной в молях на литр:
В воде концентрация ионов водорода определяется электролитической диссоциацией воды по уравнению
Константа диссоциации при 22° С составляет
Пренебрегая незначительной долей распавшихся молекул, можно концентрацию недиссоциированной части воды принять равной обшей концентрации воды, которая составляет: СH2O =1000/18=55,55моль/л.
Тогда:
Для воды и ее растворов произведение концентраций ионов Н+ и ОН- величина постоянная при данной температуре. Она называется ионным произведением воды 

Постоянство ионного произведения воды дает возможность вычислить концентрацию ионов 
и наоборот: 
Понятия кислая, нейтральная и щелочная среда приобретают количественный смысл.
В случае, если 



Если 


В любом водном растворе рН + рОН =14, где
Величина рН имеет большое значение для биохимических процессов, для различных производственных процессов, при изучении свойств природных вод и возможности их применения и т.д.
2.2 Вычисление рН растворов кислот и оснований.
Для вычисления рН растворов кислот и оснований следует предварительно вычислить молярную концентрацию свободных ионов водорода (

формулами:

Концентрация любого иона в моль/л в растворе электролита можно вычислить по уравнению
где См иона – молярная концентрация иона в моль/л;
См – молярная концентрация электролита в моль/л;

n -количество ионов данного вида, которое получается при распаде одной молекулы электролита.
Если электролит слабый, то значение степени диссоциации может быть определено на основании закона разбавления Оствальда:


Пример 1. Вычислить рН 0,001H раствора гидроксида натрия.
Решение: гидроксид натрия является сильным электролитом, диссоциация в водном растворе происходит по схеме:
Степень диссоциации в разбавленном растворе можно принять равной 1. Концентрация ионов ОН
 |
Пример 2. Вычислить рН 1%-ного раствора муравьиной кислоты, считая, что плотность раствора равна 1г/мл; Кдисс =
Решение: 1л раствора содержит 10г НСООН, что составляет 10/46= =0,22моль, где 4б г/моль — молярная масса муравьиной кислоты. Следовательно, молярная концентрация раствора равна 0,22моль/л. Муравьиная кислота – слабый электролит, поэтому


Пример 3. рН раствора составляет 4,3. Вычислить 
[Н+] = 10-рН =10-4,3 = 5∙10-5моль/л; 
2.3. Реакция в растворах солей. Гидролиз.
Реакция водного раствора зависит не только от наличия в нем кислот или оснований, но также и от присутствия некоторых солей. Многие соли, растворяясь в воде, способны смещать реакцию среды в ту или иную сторону. При этом происходит
химическое взаимодействие между ионами соли и молекулами воды, сопровождающееся образованием слабых кислот или слабых оснований или малодиссоциируемых ионов. Эта реакция получила название гидролиза солей.
Гидролиз соли — это обратимый, обменный процесс взаимодействия ионов соли с водой, приводящий к образованию слабых электролитов. В результате гидролиза изменяется кислотность среды.
Рассмотрим наиболее типичные случаи гидролиза солей.
1. Соль, образованная слабым основанием и сильной кислотой (гидролиз по катиону).
 |
В растворе накапливаются ионы
2. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону).
В данном случае гидролиз ведет к увеличению концентраций ионов 
3. Соль, образованная слабой кислотой и слабым основанием (гидролиз по катиону и по аниону).
В результате гидролиза ацетата аммония происходит образование двух слабых электролитов, раствор оказывается близким к нейтральному, рН
4. Соль, образованная сильным основанием и сильной кислотой.
Соли подобного типа гидролизу не подвергаются. Их ионы не образуют с ионами 

Особенности гидролиза солей, образованных слабыми многоосновными кислотами, а также солей, образованных слабыми многокислотными основаниями.
Гидролиз солей, образованных слабыми многоосновными кислотами, а также солей, образованных слабыми многоосновными основаниями, протекает ступенчато. В результате гидролиза по первой ступени образуются соответственно кислая или основная соль:
Накопление в растворах ионов 

2.4 Вычисление pH растворов солей
В качестве примера возьмем гидролиз ацетата натрия:
Константа равновесия этой реакции

где Кг — константа гидролиза.
Выразим 

подставив эту величину в уравнение Кг получаем
где 
В общем случае, если исходную концентрацию аниона слабой кислоты А

где: h – степень гидролиза, т.е доля молекул соли, подвергающихся гидролизу.
Константа гидролиза соли:
При малом значении h: 

Так как 
Аналогично соотношение можно получить и при рассмотрении гидролиза соли слабого основания и сильной кислоты:
Принимая во внимание, что гидролиз солей, образованных сильными основаниями и многоосновными слабыми кислотами протекает преимущественно по 1-ой ступени:
Константа гидролиза определяется уравнением:
где 
Пример 4. Определить pH 0.02Н раствора соды Na2C03, учитывая только первую ступень гидролиза.
Решение: Гидролиз соли протекает по уравнению
Для вычисления степени гидролиза необходимо вычислить молярную концентрацию раствора
2.5 Методы определения величины pH. Индикаторы
Методы определения рН могут быть различными. Для этой цели широко используются индикаторы, более точные определения рН производятся потенциометрическим методом.
Индикаторы- вещества, которые меняют свою окраску в той или иной области значений рН. Например, метиловый оранжевый меняет окраску от красной к желтой при рН от 3,1 до 4,4; фенолфталеин от бесцветной к малиновой при рН от 8,3 до 9,8(см Приложение, таблица 1). Прибавляя тот или иной индикатор к испытуемому раствору, можно с помощью эталонных растворов с тем же индикатором и известным рН установить рН исследуемого раствора путем сравнения окрасок обоих растворов.
Универсальный индикатор представляет собой смесь индикаторов с зонами перехода, последовательно охватывающими широкую область рН от кислых до щелочных значений, от рН=1 до рН=10.
Потенциометрическое определение величины рН производится лабораторным прибором — рН-метром.
Опыты выполняются строго в соответствии с методическим руководством. При выполнении работ следует выполнять общие правила техники безопасности для химических лабораторий. При попадании реактивов на кожу или одежду пораженный участок необходимо быстро обильно промыть водой.
4. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт №1. Определение рН при помощи индикаторов.
Для проведения опыта на рабочем столе находятся 5 банок с растворами электролитов. Внесите в первую колонку таблицы1формулы этих пяти электролитов и во вторую колонку (данная) значения их концентрации. На одной банке не указана концентрация (во второй колонке поставить прочерк) – раствор этого электролита будет использоваться и в первом, и во втором опытах.
Определите окраску индикаторов в растворах указанных пяти электролитов.
а) Для этого налейте в пробирки по 1мл растворов и добавьте в каждую пробирку 1-2 капли фенолфталеина. Результаты наблюдений запишите в табл.1,используя данные Приложения (таблица 1). Пробирки хорошо помыть для продолжения опыта.
б) Опыт повторите с использованием индикатора метилового оранжевого. Результаты наблюдений также запишите в табл. 1.
в) Для приближенного определения рН раствора пользуются универсальной индикаторной бумагой, или универсальными индикаторами, представляющими собой смесь нескольких индикаторов с различными областями перехода. По прилагаемой к универсальной индикаторной бумаге цветной шкале устанавливают, при каких значениях рН индикаторная бумага окрашивается в тот или иной цвет.
Стеклянной палочкой (или пробкой) нанесите 2-3 капли исследуемого раствора на универсальную индикаторную бумагу, сравните окраску еще сырого пятна с цветной шкалой. Результаты наблюдений внесите в табл. 1
Источник