- Гидролиз нитрата свинца (II)
- Общие сведения о гидролизе нитрата свинца (II)
- Гидролиз нитрата свинца (II)
- Примеры решения задач
- Пример 2. Написать молекулярные и ионно-молекулярные уравнения гидролиза нитрата свинца ( II ).
- Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: нитрат свинца (II), карбонат калия. Какие значения pH имеют растворы их солей?
Гидролиз нитрата свинца (II)
Общие сведения о гидролизе нитрата свинца (II)
Формула – Pb(NO3)2. Представляет собой порошок белого цвета. Молярная масса – 331 г/моль.
Рис. 1. Внешний вид нитрата свинца (II).
Гидролиз нитрата свинца (II)
Гидролизуется по катиону. Характер среды водного раствора нитрата свинца (II) кислый. Уравнение гидролиза будет выглядеть следующим образом:
Pb 2+ + 2NO3 — + H2O↔PbOH + + H + + 2NO3 — (полное ионное уравнение);
Pb 2+ + H2O ↔ PbOH + + H + (сокращенное ионное уравнение);
Теоретически возможна вторая ступень:
Pb(OH)NO3↔PbOH + +NO3 — (диссоциация соли);
PbOH + + NO3 — + H2O ↔ Pb(OH)2 + H + + NO3 — (полное ионное уравнение);
PbOH + + H2O ↔ Pb(OH)2 + H + (сокращенное ионное уравнение);
Примеры решения задач
| Задание | Установите соответствие между названием соли и цветом индикатора в растворе этой соли. |
| Ответ | а) нитрат бария представляет собой соль, образованную сильной кислотой (азотной) и сильным основанием (гидроксидом бария): Гидролизу не подвергается. Реакция среды раствора нитрата бария нейтральная, значит окраска лакмуса будет фиолетовой, а фенолфталеин будет бесцветным. Вариант 3. б) хлорид железа (III) представляет собой соль, образованную сильной кислотой (хлороводородной) и слабым основанием (гидроксидом железа (III)): Гидролизуется по катиону: Наличие ионов водорода свидетельствует о том, что реакция среды раствора хлорида железа (III) кислая, а значит окраска и лакмуса, и фенолфталеина будет красной. Вариант 4. в) сульфат аммония представляет собой соль, образованную сильной кислотой (серной) и слабым основанием (гидроксидом аммония): Гидролизуется по катиону: Наличие ионов водорода свидетельствует о том, что реакция среды раствора сульфата аммония кислая, а значит окраска и лакмуса, и фенолфталеина будет красной. Вариант 4. г) ацетат калия представляет собой соль, образованную слабой кислотой (уксусной) и сильным основанием (гидроксидом калия): Гидролизуется по аниону: Наличие гидроксид-ионов свидетельствует о том, что реакция среды раствора ацетата калия щелочная, а значит окраска лакмуса будет синей, а фенолфталеин останется бесцветным. Вариант 1. Источник Пример 2. Написать молекулярные и ионно-молекулярные уравнения гидролиза нитрата свинца ( II ).Соль образована катионом слабого двухкислотного основания и анионом сильной кислоты. Гидролиз идет по катиону. Раствор имеет кислую реакцию среды. Пример 3. Написать уравнение гидролиза цианида аммония NH4 CN . Какова реакция среды в водном растворе этой соли? Соль образована катионом слабого основания и анионом слабой кислоты, поэтому гидролиз идет как по катиону, так и по аниону: Для оценки реакции среды необходимо сравнить константы диссоциации NH 4 OH и HCN (см. таблицу 9.1). Так как константа диссоциации гидроксида аммония больше, чем константа диссоциации синильной кислоты, то гидроксид аммония является более сильным электролитом. Ответ: В растворе будут преобладать ионы ОН — , следовательно, реакция среды щелочная. Пример 4. Учитывая только первую ступень гидролиза 0,5М раствора Na 2 S , рассчитайте константу гидролиза, степень гидролиза и рН среды. 1. Гидролизу по первой ступени соответствует следующее ионно-молекулярное уравнение: 2. Константа гидролиза Na 2 S пo первой ступени есть отношение ионного произведения воды к константе диссоциации слабой кислоты HS — . Константа диссоциации гидросульфид — иона представляет собой константу диссоциации H 2 S по второй ступени, ее значение можно взять из табл.1. 3. Степень гидролиза можно рассчитать по формуле: h = 4. Для нахождения рН среды рассчитаем концентрацию водородных ионов: [ H + ] = K осн /С( Na2 S ) pH = — lg [ H + ] = — lg (2.82 Ответ: Кг =0,25, h = 0,71, pH =13,55 Необходимый уровень подготовки студентов 1. Знать понятия: гидролиз солей, константа гидролиза, степень гидролиза. 2. Уметь связывать склонность соли к гидролизу с силой кислот и оснований, образующих данную соль. 3. Иметь представление о факторах, влияющих на степень гидролиза. 4. Уметь выражать процесс гидролиза с помощью молекулярных и ионно-молекулярных уравнений, оценивать рН среды в водном растворе соли. рассчитывать величины константы и степени гидролиза. Лабораторная работа №10 Окислительно-восстановительные реакции Цель работы : ознакомление с окислительно-восстановительными свойствами металлов, неметаллов и их соединений; освоение методики составления уравнений окислительно-восстановительных процессов. Оборудование : 0,1 М раствор Н2 SO 4, 0,5 Н раствор С uSO 4, разбавленные растворы KMnO 4 и К4[ Fe ( CN )6], имеющие не очень интенсивную окраску, 2М раствор КОН и NaOH, кристаллические Na 2 SO 3 и иод, Zn, Mg, Fe (опилки), Cu (стружки), металлическая скрепка (кнопка), штатив, пробирки, держатель, дистиллированная вода, спиртовка, спички, бромная вода. Теоретические пояснения Реакции, протекание которых связано со смещением или полным переходом электронов от одних атомов или ионов к другим, называются окислительно-восстановительными. Число электронов, смещенных от атома (иона) данного элемента к атому (иону) данного элемента в соединении, называют степенью окисления. Степень окисления может быть положительной (электроны смещены от атома или иона) и отрицательной (электроны смещены к атому или иону). Процесс отдачи электронов, т.е. повышения степени окисления элемента, называют окислением, а вещества отдающие электроны, восстановителями. К типичным восстановителям относятся простые вещества, атомы которых характеризуются низкой электроотрицательностью (металлы, водород, углерод), некоторые анионы (CL — , S 2- , SO 3 2- и др.), катионы, у которых степень окисления может возрастать (Fe 2+ , Sn 2+ и др.), некоторые соединения углерода (углеводороды, оксид углерода), азота (азотоводороды), бора (бороводороды) и др. Процесс присоединения электронов, т.е. понижение степени окисления, называют восстановлением, а вещества, принимающие электроны, называют окислителями. К окислителям относятся простые вещества, атомы которых характеризуются высокой электроотрицательностью (элементы VI и VII групп главных подгрупп), катионы с высокой степенью окисления (Pb +4 , Cr +6 , Ge +4 ), анионы, в которых электроположительный элемент имеет высокую степень окисления (NO 3 — , Cr 2 O 7 2- , MnO 4 — и др.), высшие оксиды, а также пероксиды. Окислительно-восстановительные реакции (ОВР) – это одновременно протекающие процессы окисления и восстановления. ОВР бывают нескольких типов. 1. Реакции, в которых окислители и восстановители представляют собой разные вещества, называют межмолекулярными. 2. Если окислителями и восстановителями служат атомы или ионы одной и той же молекулы, то такие реакции называют внутримолекулярными. 3. Если окислителем и восстановителем явлются атомы или ионы одного и того же химического элемента, то такие реакции называют реакциями диспропорционирования Направление окислительно-восстановительных реакций определяется вторым законом термодинамики. Если процесс протекает при изобарно-изотермических условиях, то прямая реакция возможна при условии, что энергия Гиббса ее ниже нуля: Окислительно-восстановительную способность вещества определяет окислительно-восстановительный потенциал реакции (редокс-потенциал) окислительная способность веществ тем выше, чем больше положительное значение окислительно-восстановительного потенциала реакции. В общем виде обратимую реакцию окисления-восстановления можно записать уравнением где Ox – окисленная форма веществ; Red – восстановленная форма веществ. Уравнение окислительно-восстановительного потенциала ( где В случае если в окислительно-восстановительных реакциях участвуют катионы водорода или гидроксид анионы, потенциалы этих реакций зависят от pH, например, для реакции Методика проведения опытов Опыт 1. Восстановительные свойства металлов. а) Восстановление ионов Н + металлами. В три пробирки налейте по 2-3 мл 0,1М раствора серной кислоты. В одну пробирку внесите магний или цинк, во вторую – железо, в третью – медь. Запишите наблюдения, составьте уравнения протекающих реакций и объясните результаты опыта. б) Восстановление ионов меди металлическим железом. Прилейте в пробирку 3-5 мл 0,5н раствора сульфата меди ( II ) и погрузите в него металлическую скрепку (кнопку). Через 2 минуты выньте скрепку: что отложилось на ее поверхности? Для каких практических целей служит данная реакция? Какими химическими свойствами обладают все металлы? Назовите три положительных иона металлов с наиболее выраженными окислительными свойствами. Опыт 2. Влияние pH среды на окислительно-восстановительные реакции. а) Восстановление перманганата калия сульфитом натрия. В три пробирки налейте по три миллилитра раствора перманганата калия. В первую пробирку прилейте 2 мл 1 М раствора серной кислоты, во вторую 2 мл Н2О, в третью 2 мл 2М раствора КОН. В каждую пробирку добавьте несколько кристалликов сульфита натрия. Запишите наблюдения, составьте уравнения окислительно-восстановительных реакций и объясните результаты опыта. Учтите, что фиолетовая окраска характерна для ионов MnO 4 — , слабо-розовая (бесцветная) – для ионов Mn 2+ , бурый цвет имеют осадки М n О2 и М n (ОН)2. б) Окисление Fe ( II ) до Fe ( III ) в кислой и щелочной среде. 1. К свежеприготовленному раствору FeSO 4 (полученному растворением взятых в избытке опилок железа в разбавленной серной кислоте) прилейте раствор гидроксида натрия. Что наблюдается? Что происходит после взаимодействия полученного осадка с кислородом воздуха? Составьте уравнение реакции и объясните результаты опыта. 2. К свежеприготовленному раствору FeSO 4 добавьте 2 мл 1М раствора серной кислоты и несколько капель бромной воды. В пробирку добавьте 2 капли раствора К4[ Fe ( CN )6]. Запишите наблюдения, составьте уравнения окислительно-восстановительной реакции и объясните результаты опыта. Опыт 3. Реакции диспропорционирования. Кристаллик иода обработайте небольшим количеством 2 М раствора гидроксида натрия при слабом нагревании. Полученный раствор подкислите. Запишите наблюдения, составьте уравнения окислительно-восстановительной реакции, учитывая, что образуется иодат и иодид натрия. Дата добавления: 2019-09-13 ; просмотров: 252 ; Мы поможем в написании вашей работы! Источник Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: нитрат свинца (II), карбонат калия. Какие значения pH имеют растворы их солей?Решение: Нитрат свинца (II) Pb(NO3)2– соль слабого двухкислотного основания и сильной кислоты. Катионы слабого основания Pb 2 + связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону: Сокращенное ионно-молекулярное уравнение гидролиза: Pb 2 + + H2O полное ионно-молекулярное уравнение: Pb 2+ + 2NO3 — + H2O Pb(NO3)2+ H2O В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 2– связывают ионы водорода из воды, образуя анионы кислой соли HCO3 — . Соль гидролизуется по аниону. Сокращенное ионно-молекулярное уравнение: CO3 2– + H2O полное ионно-молекулярное уравнение: 2K + + CO3 2– + H2O K2CO3 + H2O Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7). Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: хлорид цинка, сульфит натрия. Какие значения pH имеют растворы этих солей? Решение: Хлорид цинка ZnCl2– соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли ZnOH + . Сокращенное ионно-молекулярное уравнение гидролиза: Zn 2+ + H2O полное ионно-молекулярное уравнение: Zn 2+ + 2Cl — + H2O ZnCl2+ 2H2O В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 2– связывают ионы водорода из воды, образуя анионы кислой соли HSO3 — . Соль гидролизуется по аниону. Сокращенное ионно-молекулярное уравнение: SO3 2– + H2O полное ионно-молекулярное уравнение: 2Na + + SO3 2– + H2O Na2SO3 + H2O Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7). Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей хлорид кобальта (II), нитрат алюминия. Какие значения pH имеют растворы этих солей? Решение: Хлорид кобальта (II) CoCl2– соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли CoOH + . Сокращенное ионно-молекулярное уравнение гидролиза: Co 2+ + H2O полное ионно-молекулярное уравнение: Co 2+ + 2Cl — + H2O CoCl2+ 2H2O В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 3+ связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону: Сокращенное ионно-молекулярное уравнение гидролиза: Al 3+ + H2O полное ионно-молекулярное уравнение: Al 3+ + 3NO3 — + H2O Al(NO3)3+ H2O В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH Источник |


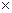 h = 10 -14 /0,5
h = 10 -14 /0,5 
 .
.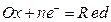 (10.1)
(10.1)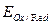 ) для этой реакции имеет вид
) для этой реакции имеет вид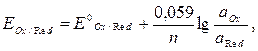 (10.2)
(10.2)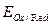 – стандартный окислительно-восстановительный потенциал;
– стандартный окислительно-восстановительный потенциал;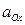 ,
, 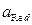 – активности соответственно окисленной и восстановленной форм веществ.
– активности соответственно окисленной и восстановленной форм веществ.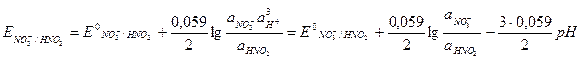
 PbOH + + H +
PbOH + + H + ZnOH + + 2Cl — + H +
ZnOH + + 2Cl — + H +