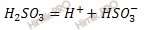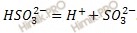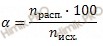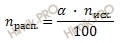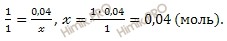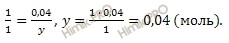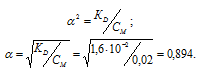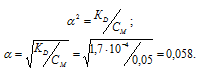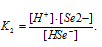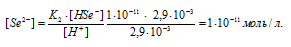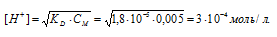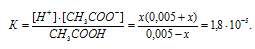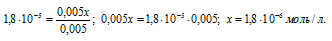Химик.ПРО – решение задач по химии бесплатно
Вычислите суммарное число моль ионов водорода (H + ) и гидросульфит-ионов (HSO3 — ), которые образуются в растворе, содержащем 0,1 моль сернистой кислоты (H2SO3). Степень диссоциации сернистой кислоты (H2SO3) в растворе по первой ступени равна 40 % (диссоциацией по второй ступени пренебречь).
Запишем уравнение диссоциации сернистой кислоты (H2SO3) по первой и второй ступени:
Первая ступень:
Учитывая, что степень диссоциации сернистой кислоты (H2SO3) в растворе по первой ступени равна 40 %, я предлагаю решить задачу, используя формулу расчета степени электролитической диссоциации:
Откуда выразим число моль электролита, распавшихся в растворе на ионы:
n (расп.) = 40 ∙ 0,1 / 100 = 0,04 (моль).
По уравнению диссоциации вычислим, сколько моль водорода (H + )и гидросульфит-ионов (HSO3 — ) образуется при диссоциации 0,04 моль сернистой кислоты (H2SO3):
при диссоциации 1 моль сернистой кислоты образуется 1 моль ионов H +
при диссоциации 4 моль сернистой кислоты образуется 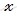
при диссоциации 1 моль сернистой кислоты образуется 1 моль HSO3 — ионов
при диссоциации 0,04 моль сернистой кислоты образуется y HSO3 — ионов
В результате получаем, что суммарное число моль ионов водорода (H + ) и сульфит-ионов (HSO3 — ) равно 0,08 моль (0,04 моль + 0,04 моль).
Ответ:
суммарное число моль ионов водорода и гидросульфит-ионов равно 0,08 моль.
Источник
Расчет степени диссоциации сернистой кислоты и других кислот
Задача 511.
Вычислить концентрацию ионов [H + ] в 0,02М растворе сернистой кислоты. Диссоциацией кислоты во второй ступени пренебречь.
Решение:
K1(H2SO3) = 1,6 . 10 -2 .
Рассчитаем степень диссоциации кислоты по уравнению: KD = CM . 
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты, 
Концентрация иона водорода будет равна произведению степени диссоциации на концентрацию кислоты:
[H + ] = 
Ответ: 0,018 моль/л.
Задача 512. ( 3 . 10 -4 )/(1,8 . 10 -6 ) = 167
Вычислить концентрацию ионов [H + ], [HSe — ] и [Se 2- ] в 0,05 М растворе H2Se.
Решение:
Уравнение диссоциации H2Se имеет вид:
Константа диссоциации H2Se равна 1,7 . 10 4 . Рассчитаем степень диссоциации кислоты по уравнению: KD = CM . 
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты, 
Концентрация иона водорода будет равна произведению степени диссоциации на концентрацию кислоты:
[H + ] = [HSe — ] = 
Уравнение диссоциации H2Se по второй ступени имеет вид:
Тогда выражение константы диссоциации иона HSe — будет иметь вид:
Ответ: [H + ] = [HSe — ] = 2,9 . 10 -3 ; [Se 2- ] = 1 . 10 -11 .
Задача 513.
Во сколько раз уменьшится концентрация ионов водорода, если к 1 л 0,005 М раствора уксусной кислоты добавить 0,05 моля ацетата натрия?
Решение:
Исходную концентрацию ионов H + в растворе (до добавления ацетата натрия( рассчитаем по уравнению:
Концентрацию ионов водорода в растворе после добавления соли обозначим через x. Тогда, концентрация недиссоциированных молекул кислоты будет равна (0,005 –x). Концентрация ацетат-ионов будет слагаться из двух величин: из концентрации, создаваемой диссоциацией молекул кислоты (CH3COOH ⇔ CH3COO — + H + ), и концентрации, обусловленной диссоциацией в растворе соли (CH3COONa ⇔ CH3COO — + Na + ). Первая из этих величин равна x, а вторая – 0,005 моль/л; общая концентрация ионов CH3COO — равна, следовательно, (0,005 + x) моль/л. Подставив значения концентраций в выражение для константы диссоциации уксусной кислоты, получим:
Так как в присутствии одноимённых ионов CH3COO — диссоциация уксусной кислоты подавляется, то степень её диссоциации мала и значением x можно пренебречь. Тогда последнее выражение упростится, получим:
При сравнении исходной концентрации ионов водорода с рассчитанной, находим, что прибавление к раствору кислоты соли вызвало уменьшение концентрации ионов водорода в 167 раз:
( 3 . 10 -4 )/(1,8 . 10 -6 ) = 167
Источник