Классификация бронхиальной астмы
Бронхиальная астма является хроническим воспалительным заболеванием дыхательных путей с прогрессирующим течением. В связи с этим, у большинства пациентов симптомы астмы наблюдаются на протяжении всей жизни.
На современном этапе не представляется возможным полностью «излечить болезнь», поэтому основной целью лечения астмы является достижение и поддержание оптимального ее контроля. Понятие «контроль астмы» включает в себя не только отсутствие клинических проявлений болезни, потребности в «спасательной» терапии, снижения функции легких, но также и предотвращение отдаленных рисков, таких как обострение болезни и побочные эффекты приема лекарственных препаратов.
Успешное лечение и контроль бронхиальной астмы не возможно без установления партнерских, доверительных отношений между врачом и пациентом. Основная задача врача – это, прежде всего, правильное определение степени тяжести заболевания и выбор соответствующей базисной противовоспалительной терапии. Тем не менее, значительная часть работы лежит именно на больном, и от его стараний во многом зависит дальнейший прогноз и течение заболевания.
Степени тяжести астмы
Бронхиальную астму классифицируют по разным критериям, но с практической точки зрения наиболее целесообразна классификация болезни по форме и по степени тяжести. Именно такой подход обеспечивает оптимальный подбор лечебных мероприятий и план ведения больного.
По форме бронхиальную астму разделяют на: аллергическую (атопическую), неаллергическую и смешанную.
Степень тяжести астмы до начала лечения определяется на основании оценки клинической картины и показателей функции внешнего дыхания по следующим показателям:
- Число ночных эпизодов за неделю. Эпизоды — это приступы, сопровождающееся свистящими хрипами, кашлем, затруднением дыхания
- количество дневных эпизодов в день и за неделю
- выраженность нарушений ночного сна и дневной активности
- значения пиковой скорости выдоха (ПСВ), объема форсированного выдоха в первую секунду (ОФВ1) и их сравнение с нормальными или лучшими персональными показателями, колебания ПСВ и ОФВ1 за сутки. Для измерения ПСВ используется метод пикфлуометрия, ОФВ1 — спирометрия.
Классификация бронхиальной астмы по тяжести:
- Интермитирующая астма: Обострения короткие; дневные симптомы появляются реже 1 раза в неделю; ночные симптомы не более 2 раз в месяц; ОФВ1 или ПСВ≥80% от должного, суточные колебания ПСВ менее 20%.
- Персистирующая легкая астма: Обострения нарушают физическую активность и сон; симптомы чаще 1 раза в неделю, но реже 1 раза в день; ночные симптомы чаще 2 раз в месяц; ОФВ1 или ПСВ≥ 80% от должного, суточные колебания ПСВ 20%-30%.
- Персистирующая средней тяжести астма: ежедневные симптомы; обострения нарушают физическую активность и сон; ночные симптомы чаще 1 раза в неделю; ОФВ1 или ПСВ – 60-80% от должной, разброс показателей ПСВ >30%.
- Персистирующая тяжелая астма: симптомы постоянные, ограничена физическая активность; ночные симптомы частые; ОФВ1 или ПСВ 30%.
В дальнейшем на фоне проводимого лечения, степень тяжести уточняется с учетом ответа на проводимую базисную терапию.
Следует помнить, что степень тяжести — это не постоянная характеристика и может существенно меняться с течением времени.
Уровни контроля бронхиальной астмы
Классификация астмы по уровню контроля имеет не менее важное значение, чем по степени тяжести. Полный контроль бронхиальной астмы любой степени тяжести предполагает полноценную жизнь без ограничений в повседневной деятельности, учебе, спорте. Неконтролируемая астма приводит к раннему развитию осложнений, значительно ухудшающих качество жизни, тяжелым приступам с высокой вероятностью летального исхода./
Критерии контроля бронхиальной астмы
Для оценки уровня контроля астмы используют следующие показатели (за период 4 недели):
- дневные симптомы, повторяющиеся чаще 2-х раз в неделю
- ночные пробуждения, вызванные эпизодами астмы
- любое ограничение активности из-за астмы
- потребность в дополнительной симптоматической (не базисной) терапии чаще 2-х раз в неделю.
Таким образом, выделяют следующие уровни контроля астмы:
- контролируемая — не наблюдается ничего из перечисленного
- частично контролируемая — соответствует 1-2 указанным критериям
- неконтролируемая астма — соответствует 3-4 критериям.
При недостаточно контролируемой астме объем базисной терапии увеличивают, а при хорошем контроле над бронхиальной астмой, наоборот — снижают. Таким образом, достижение стойкой ремиссии не только не предотвращает осложнения, но и снижает вероятность негативных последствий лечения.
Основными причинами отсутствия контроля астмы являются:
- неадекватная базисная терапия (отсутствие или недостаточный объем терапии,
- неправильная техника ингаляций,
- несоблюдение режима терапии,
- сложившиеся стереотипы назначения малоэффективных препаратов а также необоснованное использование лекарств с недоказанной клинической эффективностью (кетотифен, бромгексин, аминофиллин, теофедрин и др)
- наличие сопутствующей патологии (заболевания сердечно-сосудистой системы, ЖКТ, эндокринная патология, аллергопатология и др.)
Важную роль в достижении контроля бронхиальной астмы играет приверженность терапии, т.е. четкое выполнение рекомендаций врача, включая прием препаратов, соблюдение диеты и изменение образа жизни. Зачастую пациенты нестрого выполняют врачебные предписания, вследствие сложившихся у них стереотипов лечения, высокой стоимости препаратов, недостаточной информированности о заболевании и способах лечения.
Для обеспечения хорошего контроля астмы, важное значение имеет наличие адекватной экологической обстановки, проведение элиминационных мероприятий, выявление и лечение сопутствующих заболеваний. На сегодняшний день достижение контроля астмы возможно у большинства пациентов при условии правильной оценки тяжести, назначения адекватной противоастматической длительной базисной терапии, соблюдения режима лечения и правильной техники ингаляции.
Для оценки степени контроля у пациентов старше 12 лет, разработан тест по контролю над бронхиальной астмой, состоящий из 5 вопросов и 5 вариантов ответов на каждый из них. Каждому ответу соответствует определенное количество баллов. Если итоговая сумма составляет 25 баллов, то контроль — хороший, 20-24 балла — недостаточный, менее 20 баллов — неудовлетворительный. В такой ситуации обязательно требуется помощь врача. Тестирование можно пройти прямо сейчас, на нашем сайте.
Тяжелая и неконтролируемая астма
При определении понятия «тяжелая бронхиальная астма» необходимо отличать ее от неконтролируемой. Прежде, чем будет рассмотрен диагноз тяжелой астмы, необходимо исключить наиболее часто встречающиеся проблемы:
- Плохая техника ингаляции (до 80% больных)
- Низкая приверженность лечению (до 50% больных)
- Заболевания со сходной симптоматикой – другие болезни органов дыхания (опухоли, ХОБЛ, синдром ночного апноэ, трахеобронхиальная дискинезия, ОРВИ)
- Сопутствующие заболевания и состояния: сердечно-сосудистые заболевания (сердечная астма, ТЭЛА), гастро-эзофагальная рефлюксная болезнь, некоторые неврологические расстройства, частое и бесконтрольное применение короткодействующих β2-агонистов.
Убедившись, что степень бронхиальной астмой соответствует тяжелой, врач, как правило, увеличивает объем терапии, что чаще приводит к уменьшению симптомов и улучшению состояния пациента. Тем не менее, эффективность оценивается через 2–3 месяца терапии. При отсутствии положительного результата, лечение может быть сокращено врачом до прежнего уровня и рассмотрены альтернативные варианты лечения.
В некоторых ситуациях (во время вирусных инфекций или сезонного воздействия аллергенов) может потребоваться краткосрочное увеличение объема терапии (на 1–2 недели) за счет увеличения дозы ингаляционных кортикостероидов. Это может быть проведено врачом либо пациентом самостоятельно после предварительной консультации.
Хотя большинство пациентов могут достигнуть цели лечения и хорошо контролировать БА, некоторые пациенты не достигают контроля, несмотря на оптимально подобранную терапию. Термин «трудная в лечении» бронхиальная астма подразумевает под собой наличие различных сопутствующих заболеваний, продолжение контакта с аллергенами, низкую приверженность лечению, неадекватную ингаляционную технику.
План само выведения при бронхиальной астме
Тактика само выведения начинающихся обострений астмы подразумевает следующее:
- постоянное наблюдение за симптомами, ведение дневника
- регулярное измерение пиковой скорости выдоха (ПСВ)
- наличие индивидуального плана действий
- регулярный контакт пациента со специалистом для обсуждения вопросов лечения.
Пациенты с БА должны регулярно наблюдаться для контроля симптомов, факторов риска и возникновения обострений, а также фиксировать любые нежелательные реакции на лечение. Частота визитов к врачу зависит от исходной тяжести астмы, и составляет обычно один раз в 1-3 месяца после первого визита, в последующем каждые 3-12 месяцев. После купирования обострения болезни (в том числе после выписки из стационара) контрольный осмотр должен быть проведен в течение первой недели.
Врач совместно с пациентом составляет и обсуждает письменный индивидуальный план действий по изменению объема терапии с последующим четким выполнением инструкции со стороны пациента. Лечение назначается только врачом с учетом конкретной ситуации и сопутствующих заболеваний. Самостоятельно изменять терапию нельзя. Некоторые пациенты часто прибегают к снижению дозы стероидных препаратов из-за боязни побочных эффектов, а также предпочитают использовать лекарства при необходимости вместо того, чтобы применять поддерживающую терапию для профилактики обострений. Также распространенной ошибкой является частое использование препаратов быстрого действия (вентолин, сальбутамол, беротек и др.), которые в течение 50 лет были первой линией лечения бронхиальной астмы, а в настоящее время они вообще не рекомендованы к применению. Использование пролонгированных форм ГКС в виде внутримышечных инъекций (дипроспан) для лечения астмы также не рекомендуется в связи с развитием привыкания (тахифилаксии) и другими серьезными побочными эффектами.
Сроки уменьшения объема контролирующей терапии всегда индивидуальны и определяются только врачом. Переход на меньший объем терапии (ступень вниз) возможен при полном контроле астмы в течение 3-х и более месяцев.
Объем контролирующей терапии астмы не уменьшается в следующих ситуациях:
- наличие у пациента факторов риска обострений (курение, контакт с аллергенами и др.)
- наличие признаков респираторной инфекции
- планирование поездок/путешествий
- беременность
На течение астмы и ее контроль может существенно влиять правильность использования ингалятора. В идеале, ингаляторы назначаются только после того, как пациент прошел обучение по использованию устройства и показал удовлетворительную технику ингаляции. Выбор ингаляционного устройства для лечения стабильной астмы должен основываться на предпочтении пациента и оценке правильности использования ингалятора.
Постоянный контроль за функцией легких в домашних условиях с помощью пикфлуометра позволяет контролировать течение бронхиальной астмы и своевременно проводить коррекцию терапии. Для того чтобы помочь пациенту ориентироваться в оценке своего состояния, была разработана методика с использованием принципа «светофора». В соответствии с нею, врач на графике пациента обозначает зеленым цветом границы нормальных значений (более 80% от должных), желтым цветом – ПСВ в пределах 60-80% от должных значений и красным цветом – менее 60%. Переход в «желтую зону» указывает на начинающееся обострение и необходимость приема препаратов в соответствии с индивидуальным планом. «Красная зона» — сигнал тревоги, являющийся показанием к приему препаратов экстренной помощи и незамедлительному обращению к врачу.
Ведение дневника самоконтроля – еще одно необходимое условие успешности лечения. Пациент регулярно освещает в дневнике следующие аспекты:
- число, характер и выраженность дневных симптомов (кашель, хрипы, одышка и др.) Необходимо зафиксировать факты ограничений в работе, учебе, занятиях спортом из-за астмы и отразить при выявлении их взаимосвязи с началом приступа
- количество, характер и время возникновения ночных эпизодов и указать какие меры помогли добиться облегчения состояния
- суточная потребность в «скоропомощных» препаратах
- ежедневные и суточные результаты пикфлуометрии
- сведения о побочных эффектах приема лекарственных препаратов.
Хочется еще раз подчеркнуть, что для достижения оптимального контроля астмы и формирования высокого качества жизни пациентов, необходимо тесное сотрудничество врача и пациента. Никакие самые современные методы лечения не окажут должного эффекта, если пациент не будет четко следовать рекомендациям врача. Недостаточная осведомленность пациентов об этиологических факторах, лежащих в основе развития и обострений астмы, а также о существующих современных методах лечения, приводит к тому, что многие пациенты игнорируют назначения врачей, самостоятельно прекращают лечение или прибегают к услугам парамедиков. Для получения дополнительного образования существуют Астма-школы, специализированные Интернет-сайты, где можно получить максимальные знания об астме и путях ее преодоления.
Источник
ДИАГНОСТИКА И СТУПЕНЧАТЫЙ ПОДХОД К КЛАССИФИКАЦИИ И ЛЕЧЕНИЮ БРОНХИАЛЬНОЙ АСТМЫ
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
Несмотря на четкое определение бронхиальной астмы, достаточно яркие симптомы и возможности функциональных методов исследования диагностика заболевания вызывает трудности.
Despite the fact that bronchial asthma is well defined, its rather obvious symptoms and the capacities of functional techniques present some difficulties in diagnosing the disease. The paper outlines currently available approaches to making the diagnosis of bronchial asthma, its classification, and treatment by applying a stepwise approach.
Н. П. Княжеская, кафедра госпитальной терапии педиатрического факультета РГМУ, Москва
N.P. Knyazhevskaya, Department of Hospital Therapy, Russian State Medical University
Б ронхиальная астма — хроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клектки: тучные, зозинофилы, Т-лимфоциты. У предрасположенных лиц это воспаление приводит к повторяющимся эпизодам хрипов, одышки, тяжести в грудной клетке и кашлю, особенно ночью и/или ранним утром. Эти симптомы обычно сопровождаются распространенной, но вариабельной обструкцией бронхиального дерева, которая частично или полностью обратима спонтанно или под влиянием лечения [1].
Как показывают эпидемиологические исследования, несмотря на четкое определение заболевания, достаточно яркие симптомы и большие возможности функциональных методов исследования, бронхиальную астму плохо диагностируют, а следовательно, и плохо лечат [2]. Наиболее часто астму диагностируют как различные формы бронхита и как следствие этого неэффективно и неадекватно лечат курсами антибиотиков и противокашлевых препаратов [3 — 5]. Таким образом, распространенный тезис о том, что «все, что сопровождается свистящими хрипами, еще не является бронхиальной астмой», необходимо изменить на более соответствующий: «все, что сопровождается свистящими хрипами, следует считать астмой до тех пор, пока не будет доказано обратное» [1].
В постановке диагноза бронхиальной астмы существенное значение придается анамнезу и оценке симптомов заболевания. Наиболее распространенными симптомами являются эпизодические приступы удушья, одышки, появление свистящих хрипов, ощущение тяжести в грудной клетке, а также кашель. Однако сами по себе эти симптомы еще не являются диагнозом. Важный клинический маркер бронхиальной астмы — исчезновение симптомов спонтанно или после применения бронходилататоров и противовоспалительных препаратов. При оценке и сборе анамнеза значение придается следующим фактам: повторные обострения, чаще всего провоцируемые аллергенами, ирритантами, физической нагрузкой или вирусной инфекцией, а также сезонная вариабельность симптомов и наличие атопических заболеваний у родственников [1, 6, 7].
Поскольку симптомы астмы меняются в течение дня, нормальные данные можно получить при физикальном обследовании. Во время обострения астмы спазм гладкой мускулатуры, отек и гиперсекреция ведут к обструкции мелких бронхов, аускультативно врач чаще всего выслушивает сухие хрипы. Однако необходимо помнить, что у некоторых больных даже в период обострения при аускультации хрипы могут не выслушиваться, в то время как с помощью объективных исследований будет зарегистрирована значительная бронхообструкция, вероятно, за счет преобладающего вовлечения в процесс мелких дыхательных путей. Поэтому измерение функции внешнего дыхания (ФВД) обеспечивает объективную оценку бронхообструкции, а измерение ее колебаний — непрямую оценку гиперреактивности дыхательных путей. Существует широкий диапазон различных методов оценки степени бронхиальной обструкции, но наиболее широкое применение получили измерение объема форсированного выдоха за 1 с (ОФВ1) и связанное с ним измерение форсированной жизненной емкости легких (ФЖЕЛ), а также измерение форсированной (пиковой) скорости выдоха (ПСВ) [8].
Вероятно наиболее важное нововведение в диагностике и контроле бронхиальной астмы — это появление пикфлоуметра. Регулярный домашний мониторинг полезен, так как он помогает врачам и пациентам выявить ранние признаки ухудшения состояния и принять необходимые препараты.
Многие исследования продемонстрировали, что предъявляемые пациентами жалобы не соответствуют степени бронхиальной обструкции.
Неправильная оценка степени тяжести течения астмы самим больным и его врачом является основным фактором, обусловливающим недостаточно адекватное противовоспалительное лечение, и может привести к тяжелому обострению или даже к летальному исходу. Применение пикфлоуметрии позволяет достаточно точно диагностировать и классифицировать тяжесть течения бронхиальной астмы и соответственно назначать противовоспалительную поддерживающую терапию с учетом тяжести заболевания, т. е. осуществлять так называемый ступенчатый подход [9].
Наряду с оценкой симптомов, анамнеза физикальных данных и показателей ФВД для постановки диагноза имеет большое значение изучение аллергологического статуса. Наиболее часто используются скарификационные, внутрикожные и уколочные (прик-тест) тесты.
Однако в ряде случаев кожные тесты приводят к ложнонегативным или ложнопозитивным результатам. Поэтому часто проводится исследование специфических IgE-антител в сыворотке крови.
| Диагностика астмы строится на основании анализа симптомов и анамнеза, а также исследовании ФВД. Наиболее важными легочными функциональными тестами являются выявление ответа на ингаляции b 2 -агонистов, изменение вариабельности бронхиальной проходимости с помощью мониторирования ПСВ, провокации с помощью физической нагрузки у детей. Ценным дополнением к диагностике является определение аллергологического статуса. |
Как было уже сказано, бронхиальную астму довольно часто неправильно диагностируют и как следствие этого назначают неправильную терапию. Особенно трудно диагностировать астму у детей, пожилых людей, а также при воздействии профессиональных факторов риска, сезонности заболевания и при кашлевом варианте астмы.
Диагностика астмы у детей представляет чаще всего большие трудности в связи с тем, что эпизоды свистящих хрипов и кашель являются наиболее частыми симптомами детских болезней. Помощь в постановке диагноза оказывает выяснение семейного анамнеза, атопического фона. Повторные приступы ночного кашля у детей, в остальном практически здоровых, почти наверняка подтвержают диагноз бронхиальной астмы [10]. У некоторых детей симптомы астмы провоцирует физическая нагрузка [11].
Другой группой больных, в которой диагноз астмы (при позднем начале) врач или не ставит, или пропускает, являются люди пожилого возраста. У них трудно не только диагностировать астму, но и оценить тяжесть ее течения. Тщательный сбор анамнеза, обследование, направленное на исключение других заболеваний, сопровождающихся подобной симптоматикой (прежде всего ишемической болезни сердца с признаками левожелудочковой недостаточности), а также функциональные методы исследования, включающие также регистрацию электрокардиограмм и проведение рентгенологического исследования, обычно проясняют картину [12].
Диагностика профессиональной астмы также представляет определенную сложность. Известно, что многие химические соединения, присутствуя в окружающей среде, вызывают астму.
Они варьируют от высокоактивных низкомолекулярных соединений, таких как изоцианаты, до известных низкомолекулярных соединений, таких как изоцианаты, до известных иммуногенов, таких как соли платины, растительных комплексов и продуктов животного происхождения. Для постановки диагноза нужен четкий анамнез: отсутствие симптомов до начала работы, подтвержденная связь между развитием симптомов астмы на рабочем месте и их исчезновением после ухода с данного рабочего места. Точно подтвердить диагноз бронхиальной астмы можно при помощи исследования показателей ФВД: измерения ПСВ на работе и вне рабочего места, проведение специфических провокационных тестов. Следует учитывать, что даже при прекращении воздействия повреждающего агента сохраняется и продолжает ухудшаться течение бронхиальной астмы. Поэтому очень важны ранняя диагностика профессиональной астмы, прекращение контакта с повреждающим агентом, а также рациональная фармакотерапия.
Сезонная астма обычно связана с аллергическим ринитом. В период между сезонами симптомы бронхиальной астмы могут полностью отсутствовать. При постановке диагноза большое значение имеют анамнез и углубленное аллергообследование, а также измерение показателей ФВД и проведение ингаляционных тестов с b 2-агонистами в период обострения.
Кашлевой вариант астмы представляет значительную трудность в диагностике данного заболевания. Кашель практически является основным, а иногда и единственным симптомом. У таких больных кашель часто возникает в ночные часы и, как правило, не сопровождается свистящими хрипами. При исследовании показетелей ФВД в дневные часы часто регистрируются нормальные значения. Для правильной постановки диагноза большое значение имеет определение вариабельности показателей ФВД в сочетании с поисками эозинофилов в мокроте и диагностическими тестами для выявления гиперчувствительности [13].
Классификация бронхиальной астмы проводится на основании этиологии, тяжести течения и особенностей проявления бронхиальной обструкции. В прошлые годы из-за отсутствия понимания основополагающих процессов, происходящих при астме, основной упор делали на более очевидные проявления бронхиальной астмы, а именно на острое воспаление, бронхоспазм и ограничение воздушного потока [14]. Это привело к преимущественному использованию бронходилататоров для коррекции всех проявлений астмы. В настоящее время известно, что воспаление воздушных путей подразумевает как обострение, так и хроническое течение астмы. В связи с этим произошло изменение подходов к лечению болезни по направлению к длительному использованию противовоспалительных лекарств. Для подбора адекватной противовоспалительной терапии важно определить тяжесть течения бронхиальной астмы. Ни один тест не позволит точно классифицировать степень тяжести бронхиальной астмы. Однако комбинирование оценки симптомов и показателей ФВД дает характеристику болезни в зависимости от степени тяжести.
Установлено, что оценка течения бронхиальной астмы, основанная на клинических проявлениях болезни, связана с показателями степени воспаления дыхательных путей [15].
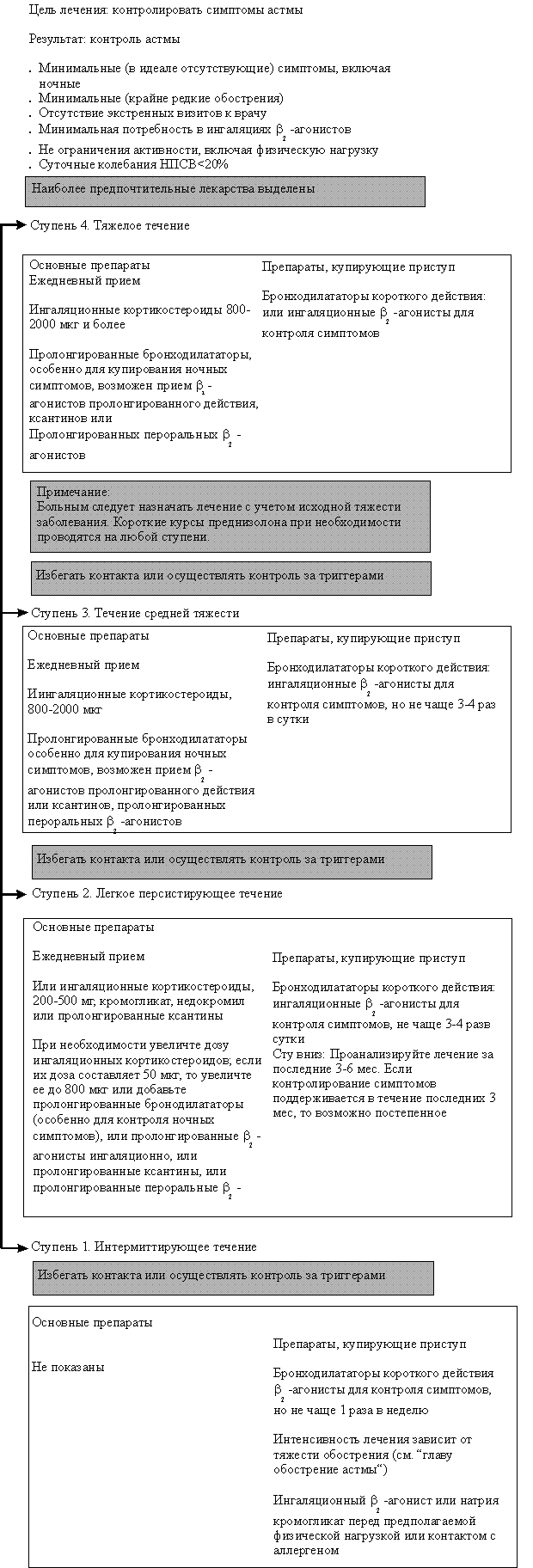
Как уровень обструкции, так и степень ее обратимости позволяют подразделить астму по степени тяжести на интермиттирующую, легкую персистирующую (хронического течения), средней тяжести (умеренную) и тяжелую [16]. При лечении астмы в настоящее время применяют ступенчатый подход, при котором интенсивность терапии увеличивается по мере увеличения степени тяжести астмы (рис. 1).
| Ступенчатый подход к терапии астмы рекомендуется в связи с большим разнообразием тяжести течения астмы у различных людей и у одного и того же пациента в разные временны’е периоды. Цель такого подхода — достижение контроля над заболеванием с применением наименьшего количества препаратов. Количество и частота приема лекарств увеличиваются (ступень вверх), если течение астмы ухудшается, и уменьшается (ступень вниз), если течение астмы хорошо контролируется. Ступенчатый подход также предполагает необходимость избегать или контролировать триггеры на каждой ступени. |
После определения тяжести течения астмы у больного (см. рис. 1) врач должен решить вопрос о том, стоит ли проводить вначале максимальное лечение для наиболее быстрого достижения контроля над астмой с последующим снижением препаратов (ступень вниз) или начать лечение с небольшого объема лекарств, а затем усиливать его (ступень вверх) при необходимости. В любом случае если удается контролировать симптомы астмы в течение 3 мес, то можно тщательно обдумать вопрос об уменьшении терапии (ступень вниз). Переход на более низкую ступень позволяет установить наименьший объем терапии, необходимый для контроля.
Подходы к лечению в зависимости от тяжести течения астмы показаны на рис. 2. Следует учитывать, что наименьшая тяжесть течения астмы представлена в 1-й ступени, а наибольшая — в 4-й ступени. Ступенчатый подход к лечению предусматривает подъем на более высокий уровень, если контроль над астмой не удается достичь или он потерян. Однако при этом необходимо учитывать, правильно ли больной принимает лекарства соответствующей ступени и нет ли контакта с аллергенами или другими провоцирующими факторами.
Контроль считается неудовлетворительным, если у больного наблюдаются:
|
Ступень 1. Больные с легким интермиттирующим течением астмы — это пациенты, у которых симптомы астмы появляются только при контакте с аллергенами (например, пыльца или шерсть животных) или обусловлены физической нагрузкой, а также дети, у которых свистящее дыхание возникает во время респираторно-вирусной инфекции нижних дыхательных путей.
Интермиттирующая астма — это не обычная форма болезни. Тяжесть обострений может значительно варьировать у различных больных в разное время. Такие обострения могут быть даже угрожающими для жизни, хотя это встречается крайне редко при интермиттирующем течении заболевания.
Длительная терапия противовоспалительными препаратами, как правило, не показана этим больным. Лечение включает профилактическй прием лекарств перед физической нагрузкой при необходимости (ингаляционные b 2-агонисты или кромогикат, или недокормил). Как альтернатива для ингаляционных b 2-агонистов короткого действия могут быть предложены антихолинергические препараты, пероральные b 2-агонисты короткого действия или тнофиллины короткого действия, хотя эти препараты начинают действие позднее и/или у них выше риск развития побочных проявлений.
Иногда более тяжелые и длительные обострения требуют назначения короткого курса пероральных кортикостероидов (см. рис. 2).
Ступень 2. Больные с легким персистирующим течением астмы нуждаются в ежедневном длительном профилактическом приеме лекарств для достижения и поддержания контроля над астмой. Первичная терапия — это прием противовоспалительных препаратов. Лечение можно начинать с ингаляционных кортикостероидов, кромогликата натрия или недокромила натрия. Предлагаемая доза кортикостероидов — 200 — 500 мкг беклометазона дипропионата или будесонида, или ингакорта, или другого эквивалента в день. Может быть предложена терапия теофиллинами пролонгированного действия. Однако необходимость контролировать концентрацию его в плазме (терапевтический разброс 5 — 15 мг/л) может сделать такое лечение не всегда возможным. Ингаляционные b 2-агонисты можно использовать для облегчения симптомов, но частота их приема не должна превышать 3 — 4 раз в сутки. Как альтернатива для ингаляционных b 2 -агонистов короткого действия могут быть предложены антихолинергические препараты, пероральные b 2 -агонисты короткого действия или теофиллины короткого действия, хотя эти препараты начинают действие позднее и/или у них выше риск развития побочных проявлений. Если больной принимает теофиллины пролонгированного действия, то прежде всего следует определить концентрацию теофиллина в плазме перед назначением теофиллинов короткого действия. При более тяжелых и длительных обострениях требуется назначение короткого курса пероральных кортикостероидов.
Если симптомы персистируют несмотря на начальную дозу ингаляционных кортикостероидов и врач уверен в том, что больной правильно использует препараты, дозу ингаляционных препаратов следует увеличить от 400 — 500 до 750 — 800 мкг в день (беклометазона дипропионат или эквивалент). Возможной альтернативой увеличению дозы ингаляционных гормонов, особенно для контроля ночных симптомов астмы (к дозе по крайней мере 500 мкг ингаляционных кортикостероидов), может быть назначение бронходилататоров пролонгированного действия на ночь.
Если контроля не удается достичь, что выражается более частыми симптомами, увеличением потребности в бронходилататорах или падением показателей ПСВ, то следует начать лечение по 3-й ступени.
Ступень 3. Больные со средней тяжестью течения астмы требуют ежедневного приема профилактических противовоспалительных препаратов для установления и поддержания контроля над астмой. Доза ингаляционных кортикостероидов должна быть на уровне 800 — 2000 мкг беклометазона дипротионата или его эквивалента. Рекомендуется использовать ингалятор со спейсером. Бронходилататоры длительного действия могут быть также назначены в добавление к ингаляционным кортикостероидам, особенно для контроля ночных симптомов. Можно применять теофиллины длительного действия, пероральные и ингаляционные b 2-агонисты длительного действия. Необходимо мониторировать концентрацию теофиллина длительного действия (обычный диапазон терапевтической концентрации 5 — 15 мкг на 1 мл). Купировать симптомы следует b 2-агонистами короткого действия или альтернативными препаратами, как описано во 2-й ступени. При более тяжелых обострениях можно проводить курс пероральных кортикостероидов.
Если контроля не удается достичь, что выражается более частыми симптомами, увеличением потребности в бронходилататорах, или падением показателей ПСВ, то следует начать лечение по 4-й ступени.
Рис. 1. Длительный контроль над астмой: диагностируйте и классифицируйте тяжесть течения
Рис.2. Длительный контроль над астмой: лечение с учетом ступенчатого подхода
Ступень 4. Больным с тяжелым течением бронхиальной астмы полностью контролировать астму не удается. Целью лечения становится достижение возможно лучших результатов: минимальное количество симптомов, минимальная потребность в b 2 -агонистах короткого действия, лучшие возможные показатели ПСВ, минимальный разброс ПСВ и минимальные побочные проявления от приема препаратов. Лечение обычно проводят с помощью большого количества контролирующих течение астмы препаратов.
Первичное лечение включает ингаляционные кортикостероиды в высоких дозах (от 800 до 2000 мкг в день беклометазона дипропионата или его эквивалента). В добавление к ингаляционным кортикостероидам рекомендуются пролонгированные бронходилататоры. Для достижения эффекта можно также 1 раз в день применять b 2 -агонисты короткого действия. Можно попробовать применить антихолинергический препарат (атровент), особенно больным, которые отмечают побочные явления при приеме b 2 -агонистов. При необходимости для облегчения симптомов можно использовать ингаляционные b 2 -агонисты короткого действия, но частота их приема не должна превышать 3 — 4 раз в сутки. Более тяжелое обострение может потребовать проведения курса пероральных кортикостероидов.
Длительное лечение пероральными кортикостероидами следует проводить в минимальных дозах или, если возможно, через день. Лечение высокими дозами ингаляционных кортикостероидов назначают через спейсер, что способствует более эффективному контролю и снижает некоторые побочные проявления.
Ступень вниз. Снижение поддерживающей терапии возможно, если астма остается под контролем не менее 3 мес. Это помогает снизить риск побочного действия и повышает восприимчивость больного к планируемому лечению. Уменьшать терапию следует ступенчато, понижая или отменяя последнюю дозу или дополнительные препараты. Необходимо наблюдать за симптомами, клиническими проявлениями и показателями ФВД.
Таким образом, хотя бронхиальная астма — заболевание неизлечимое, вполне уместно ожидать, что у большинства больных может и должен быть достигнут контроль за течением заболевания.
Важно также отметить, что подход к диагностике, классификации и лечению астмы с учетом тяжести ее течения позволяет создавать гибкие планы и специальные лечебные программы в зависимости от доступности противоастматических препаратов, системы регионального здравоохранения и особенностей конкретного больного.
1. Бронхиальная астма. Глобальная стратегия. Приложение к журналу Пульмонология. Москва. 1996;196.
2. Burney PGJ. Current questions in the epidemiology of asthma, in Holgate ST, et al (eds), Asthma: Physiology. Immunology, and Treatment. London, Academic Press, 1993;3-25.
3. Чучалин А.Г. Бронхиальная астма. М., 1985.
5. Wilson NM. Wheezy bronchitis revisited. Arch Dis Child 1989;64:1194-9.
6. Федосеев Г.Б., Емельянов А.В. Бронхиальная астма: трудные и нерешенные проблемы. Тер. арх. 1991;3:74-8.
7. Abramson MJ, et al. Evaluation of a new asthma questionnaire. J Asthma 1991;28:165-73.
8. Lebowitz MJ. The use of peak expiratory flow rate measurements in respiratory disease. Pediatr Pulmonol 1991;11:166-74.
9. Novak rm, et al. Comprison of peak expiratory flow and FEV1 admission criteria for acute bronchial asthma. Ann Emerg Med 1982;11:64-9.
10. Sporik R, Holgate ST, Codswell JJ. Natural history of asthma in childhood — a birth cohort study. Arch Dis Child 1991;66:1050-3.
11. Eggleston PA. Exercise — induced asthma, in Tinkelman DG, Npitz CK (eds), Childhood Asthma: Pathophysiology and Treatment, 2 nd. New York 6 Marcel Dekker, 1992;429-46.
12. Dow L, Coddon D, Holgate ST. Respiratory symptoms as predictors of airways in an elderly population. Respir Med 1992;146:402-7.
13. Cloutier MM, Loughlin GV. Chronic cough in children: a manifestation of airway hyperreactivity. Pediatrics 1981;67:6-12 Bousquet J, et al. Eosinophilic inflammation in asthm a. N Engl J Med 1990;323:1033-9.
14. Чучалин А.Г. Лечебные программы бронхиальной астмы. Тер. арх. 1987;3:111-6.
15. Bousquet J, et al. Eosinophilic inflammation in asthma. N Engl J Med 1990;323:1033-9.
16. British Thoracic Society, et al. Gui delines on the managment of asthma. Thorax 1993;48:1-24.
Источник