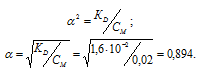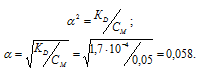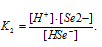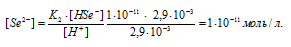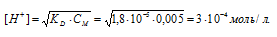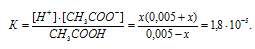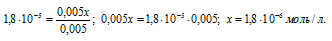Расчет степени диссоциации сернистой кислоты и других кислот
Задача 511.
Вычислить концентрацию ионов [H + ] в 0,02М растворе сернистой кислоты. Диссоциацией кислоты во второй ступени пренебречь.
Решение:
K1(H2SO3) = 1,6 . 10 -2 .
Рассчитаем степень диссоциации кислоты по уравнению: KD = CM . 
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты, 
Концентрация иона водорода будет равна произведению степени диссоциации на концентрацию кислоты:
[H + ] = 
Ответ: 0,018 моль/л.
Задача 512. ( 3 . 10 -4 )/(1,8 . 10 -6 ) = 167
Вычислить концентрацию ионов [H + ], [HSe — ] и [Se 2- ] в 0,05 М растворе H2Se.
Решение:
Уравнение диссоциации H2Se имеет вид:
Константа диссоциации H2Se равна 1,7 . 10 4 . Рассчитаем степень диссоциации кислоты по уравнению: KD = CM . 
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты, 
Концентрация иона водорода будет равна произведению степени диссоциации на концентрацию кислоты:
[H + ] = [HSe — ] = 
Уравнение диссоциации H2Se по второй ступени имеет вид:
Тогда выражение константы диссоциации иона HSe — будет иметь вид:
Ответ: [H + ] = [HSe — ] = 2,9 . 10 -3 ; [Se 2- ] = 1 . 10 -11 .
Задача 513.
Во сколько раз уменьшится концентрация ионов водорода, если к 1 л 0,005 М раствора уксусной кислоты добавить 0,05 моля ацетата натрия?
Решение:
Исходную концентрацию ионов H + в растворе (до добавления ацетата натрия( рассчитаем по уравнению:
Концентрацию ионов водорода в растворе после добавления соли обозначим через x. Тогда, концентрация недиссоциированных молекул кислоты будет равна (0,005 –x). Концентрация ацетат-ионов будет слагаться из двух величин: из концентрации, создаваемой диссоциацией молекул кислоты (CH3COOH ⇔ CH3COO — + H + ), и концентрации, обусловленной диссоциацией в растворе соли (CH3COONa ⇔ CH3COO — + Na + ). Первая из этих величин равна x, а вторая – 0,005 моль/л; общая концентрация ионов CH3COO — равна, следовательно, (0,005 + x) моль/л. Подставив значения концентраций в выражение для константы диссоциации уксусной кислоты, получим:
Так как в присутствии одноимённых ионов CH3COO — диссоциация уксусной кислоты подавляется, то степень её диссоциации мала и значением x можно пренебречь. Тогда последнее выражение упростится, получим:
При сравнении исходной концентрации ионов водорода с рассчитанной, находим, что прибавление к раствору кислоты соли вызвало уменьшение концентрации ионов водорода в 167 раз:
( 3 . 10 -4 )/(1,8 . 10 -6 ) = 167
Источник
Константа диссоциации. В растворах слабых электролитов устанавливается динамическое равновесие между ионами и недиссоциированными молекулами



В растворах слабых электролитов устанавливается динамическое равновесие между ионами и недиссоциированными молекулами, условно:
Константу равновесия при диссоциации называют константой диссоциации ( 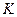
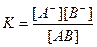
где 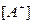
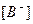
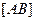
Константа диссоциации, так же как и степень диссоциации, зависит от природы растворённого вещества и растворителя, от температуры. Константа диссоциации, как и любая константа равновесия, не зависит от концентрации раствора. Чем слабее электролит, тем меньше константа диссоциации. Значения констант диссоциации слабых электролитов при 298 К приведены в справочниках, в дальнейшем при использовании справочных значений констант диссоциации температуру указывать не будем.
Рассмотрим примеры уравнений, описывающих диссоциацию некоторых слабых электролитов в водных растворах.
· Диссоциация слабых кислот.
Кислоты диссоциируют с образованием ионов водорода. Процессу диссоциации слабой уксусной кислоты соответствует уравнение
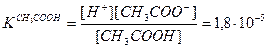
Многоосновные кислоты диссоциируют ступенчато. Число ступеней диссоциации равно основности кислоты. Так, процесс диссоциации двухосновной сероводородной кислоты характеризуют двумя ступенями.
Первую ступень диссоциации описывают уравнением:
константа диссоциации по первой ступени:
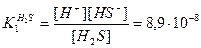
Уравнение диссоциации по второй ступени:
константа диссоциации по второй ступени:
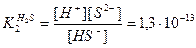
Диссоциация по первой ступени проходит в большей степени, чем по второй, 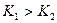
Образованием при диссоциации многоосновных кислот сложных ионов объясняется существование кислых солей (NaHS, KHCO3, CaHPO4 и др.).
· Диссоциация слабых оснований.
Основания диссоциируют с образованием гидроксид-ионов OH — . Слабые основания, содержащие несколько гидроксид-ионов, диссоциируют по ступеням, например:
Fe(OH)2 FeOH + + OH — , 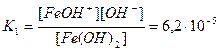
FeOH + Fe 2+ + OH — , 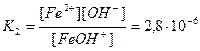
Образованием при диссоциации сложных ионов объясняется существование основных солей (FeOHCl, (CuOH)2CO3 и др.)
Источник
Вычислить [H+] и рН
Первый способ – по готовой формуле, которую легко найти в интернете, набрав в поисковике: расчет рН.
Формула для рН раствора слабой кислоты: рН = ½ рК — ½ lgC(кисл) , где К – константа диссоциации кислоты (в данном случае двухосновная кислота рассматривается как одноосновная, потому что диссоциацией по второй ступени пренебрегают, т. е. К = К1 – константа данная в условии задачи) , рК=-lgК = 7,22.
рН = ½*7,22 — ½*lg0,2 = 3,61+0,35 = 3,96
Концентрацию ионов водорода найдем из условия, что рН = -lg[H+], отсюда [H+] = 10 в степени –рН, т. е 10 в степени -3,96 (считаем на калькуляторе)
[H+] = 0,0001096 = 1,096*10^(-4), т. е. 1,096 на 10 в степени -4. Можно, наверное, округлить и записать, что [H+] = 1,1*10^(-4).
Второй способ, пользуясь законом разведения Оствальда (откуда вообще-то и готовая формула выводилась) .
Записываем уравнение диссоциации (по первой стадии) :
H2S = H(+) + HS(-)
Концентрация ионов водорода [H+] = αС, где α – степень диссоциации, С – концентрация кислоты.
По закону разбавления Оствальда константа диссоциации К = Сα^2 (цэ на альфа в квадрате) .
Степень диссоциации α будет равна квадратному корню из К/С (считать на калькуляторе) α = 5,48*10^(-4), т. е. 5,48 на 10 в минус 4 степени.
Концентрация ионов водорода [H+] = αС = (считать на калькуляторе) = 1,096 на 10 в минус 4 степени.
Вообще надо еще учесть концентрацию ионов водорода в воде, т. е. прибавить к полученной величине 1*10^(-7). Получится [H+] = 1,097 умножить на 10 в минус 4 степени (поправка мало влияет на результат) . В данном случае можно пренебречь этим действием. Но если бы концентрация кислоты была на 1-2 порядка меньше, то концентрацию ионов водорода в воде надо было бы обязательно учесть.
Теперь вычисляем рН = -lg[H+] = (считать на калькуляторе) = 3,95979… =3,96.
Ничего не изменится, если мы округлим [H+] до 1,1*10^(-4). рН все равно округленно будет равно 3,96.
Источник
Константы диссоциации кислот и оснований в водных
растворах.
В таблицах приводятся как термодинамические константы диссоциации, вычисленные с учетом коэффициентов активности, так и концентрационные («кажущиеся») константы диссоциации.
Данные, относящиеся к разным ступеням диссоциации отмечены римскими цифрами. Если дается только одно значение константы, то оно относится к первой ступени диссоциации. Для угольной кислоты и гидроксида аммония приводятся «истинные» константы диссоциации, учитывающие, что не весь растворенный СО2 и NН3 находятся в растворе в виде Н2СО3 и NH4ОН.
Для кислот даны константы кислотности и показатели кислотности рКа=-lgКа. Для неорганических оснований приведены константы основности и показатели основности рКb=-lgКb.Для органических оснований даны константы основности и показатели констант кислотности сопряженных с данными основаниями кислот:
рКа=рКω-рКb, где Кω-ионное произведение воды, а рКω=-lgКω.
Константы диссоциации некоторых органических
И неорганических оснований
| Название | Формула | Кb | рКb | |
| Анилин | С6Н5NН2 Н2О | 4,2 10 -10 | 9,38 | |
| Гидразин | N2H4 H2O | 9,8 10 6 | 6,01 | |
| Гидроксид алюминия | А1(ОН)3 | (III) 1,38 10 -9 | 8,86 | |
| Гидроксид аммония (истинная) | NH4ОН | 6,3 10 -5 | 4,20 | |
| Гидроксид аммония (кажущаяся) | NH4ОН | 1,79 10 -5 | 4,75 | |
| Гидроксид бария | Ва(ОН)2 | 2,3 10 -1 | 0,64 | |
| Гидроксид ванадия | V(OH)3 | (III) 8,3 10 -12 | 11,08 | |
| Гидроксид галлия | Ga(OH)3 | (II) 1,6 10 -11 | 10,80 | |
| (III) 4 10 -12 | 11,40 | |||
| Гидроксид железа (II) | Fe(OH)2 | (II)1,3 10 -4 | 3,89 | |
| Гидроксид железа (III) | Fe(OH)3 | (II) 1,82 10 -11 | 10,74 | |
| (III) 1,35 10 -12 | 11,87 | |||
| Гидроксид кадмия | Cd(OH)2 | (II) 5 10 -3 | 2,30 | |
| Гидроксид кальция | Са(ОН)2 | I) 4,3 10 -2 | 1,37 | |
| II) 4 10 -3 | 2,40 | |||
| Гидроксид кобальта | Со(ОН)2 | 4 10 -5 | 4,40 | |
| Гидроксид лантана | La(OH)3 | (III) 5,2 10 -4 | 3,30 | |
| Гидроксид лития | LiOH | 6,75 10 -1 | 0,17 | |
| Гидроксид магния | Mg(OH)2 | (II) 2,5 10 -3 | 2,60 | |
| Гидроксид марганца (II) | Mn(OH)2 | (II) 5 10 -4 | 3,30 | |
| Гидроксид меди(II) | Cu(OH)2 | (II) 3,4 10 -7 | 6,74 | |
| Гидроксид натрия | NaOH | 5,9 | -0,77 | |
| Гидроксид никеля | Ni(OH)2 | (II) 2,5 10 -5 | 4,60 | |
| Гидроксид свинца | Pb(OH)2 | I)9,6 10 -4 | 3,02 | |
| II) 3,0 10 -8 | 7,52 | |||
| Гидроксид серебра | AgOH | 5 10 -3 | 2,30 | |
| Гидроксид скандия | Sc(OH)3 | (III) 7,6 10 -10 | 9,12 | |
| Гидроксид стронция | Sr(OH)2 | (II) 1,5 10 -1 | 0,82 | |
| Гидроксид таллия | Т1(ОН) | >10 -1 | -10 | 9,70 |
| Гидроксид хрома(III) | Cr(OH)3 | (III) 1,02 10 -10 | 9,99 | |
| Название | Формула | Кb | рКb | |
| Гидроксид цинка | Zn(OH)2 | (II) 4 10 -5 | 4,4 | |
| Гидроксид олова (II) | Sn(OH)2 | (II) 1,26 10 -12 | 11,89 | |
| Гидроксид олова (IV) | Sn(OH)4 | (II) 2,14 10 -14 | 13,67 | |
| Гидроксиламин | NH2OH H2O | 9,33 10 -9 | 8,03 | |
| Гидроксид тория (IV) | Th(OH)4 | (III) 2,0 10 -11 | 10,69 | |
| Гидроксид титана (IV) | Ti(OH)4 | (II) 3,09 10 -13 | 12,5 | |
| Гидроксид таллия (I) | TlOH | 1,51 10 -1 | 0,82 | |
| Гидроксид таллия (III) | Tl(OH)3 | (III) 1,74 10 -13 | 12,76 | |
| Гидроксид циркония (IV) | Zr(OH)4 | (II) 1,62 10 -14 | 13,79 | |
| Гуанидин | (Н2N)2CNH H2O | 3 10 -1 | 0,52 | |
| Диметиламин | (СН3)2NH H2O | 1,1 10 -3 | 2,97 | |
| Дифениламин | (С6Н5)2NH H2O | 7,1 10 -14 | 13,15 | |
| Диэтиламин | (С2Н5)2NH H2O | 9,6 10 -4 | 3,02 | |
| Метиламин | NH2CH3 H2O | 4,2 10 -4 | 3,77 | |
| Мочевина | СО(NH2)2 H2O | 1,5 10 -14 | 13,82 | |
| α-Нафтиламин | С10Н7NH2 H2O | 8,4 10 -11 | 10,08 | |
| β-Нафтиламин | С10Н7NH2 H2O | 1,3 10 -10 | 9,89 | |
| 8 Оксихинолин | С9Н7ON Н2О | 1 10 -9 | 8,99 | |
| Пиридин | С5Н5N H2O | 1,5 10 -9 | 8,82 | |
| Тиомочевина | СS(NH2)2 H2O | 1,35 10 -13 | 11,87 | |
| Триметиламин | (CH3)3N H2O | 8,1 10 -5 | 4,09 | |
| Уротропин | (СН2)6N4 H2O | 1,4 10 -9 | 8,87 | |
| Фенилгидразин | С6H5NHNH2 H2O | 1,6 10 -9 | 8,8 | |
| Хинолин | С9Н7N H2O | 6,3 10 -10 | 9,2 | |
| Этиламин | СH3CH2NH2 H2O | 4,7 10 -4 | 3,33 | |
| Этилендиамин | (H2NCH2)2 H2O | (I)9,1 10 -5 | 4,04 | |
| (II)1,5 10 -7 | 6,82 |
Константы диссоциации некоторых неорганических кислот
| Название | Формула | Кa | рКa |
| Азотистая | HNO2 | 4 10 -4 | 3,40 |
| Азотистоводородная | HN3 | 2,6 10 -5 | 4,59 |
| Азотная | HNO3 | 4,36 10 | -1,64 |
| Азотноватистая | H2N2O2 | 2,51 10 -12 | 11,60 |
| Название | Формула | Кa | рКa |
| Алюминиевая (мета) | HA1O2 | 6 10 -13 | 12,22 |
| Борная (мета) | HBO2 | 7,5 10 -10 | 9,12 |
| Борная (орто) | H3BO3 | (I)5,8 10 -10 (II)1,8 10 -13 (III)1,6 10 -14 | 9,24 12,74 13,80 |
| Борная, четырех | H2B4O7 | (I)10 -4 (II)10 -9 | 4,00 9,00 |
| Борофтористоводородная | HBF4 | 3,2 10 -1 | 0,49 |
| Бромноватая | HBrO3 | 2 10 -1 | 0,70 |
| Бромноватистая | HBrO | 2,06 10 -9 | 8,70 |
| Бромоводородная | HBr | 10 9 | -9,00 |
| Ванадиевая | H3VO4 | (III) 4,0 10 -15 | 14,4 |
| Вольфрамовая | H2WO4 | (II) 2 10 -4 | 3,7 |
| Водорода пероксид | H2O2 | 2,63 10 -12 | 11,58 |
| Гидроксид галлия | H3GaO3 | (II)5 10 -11 (III)2 10 -12 | 10,30 11,70 |
| Германиевая | H2GeO3 | (I)1,7 10 -9 (II)1,9 10 -13 | 8,77 12,72 |
| Дитионистая | H2S2O4 | (II) 3,55 10 -3 | 2,45 |
| Дитионовая | H2S2O6 | (I) 6,3 10 -1 | 0,20 |
| (II) 4 10 -4 | 3,4 | ||
| Двумолибденовая | H2Mo2O7 | 9,55 10 -6 | 5,02 |
| Дихромовая | H2Cr2O7 | (II) 2,29 10 -2 | 3,64 |
| Железистосинеродистая | H4Fe(CN)6 | (III) 10 -3 (IV)6,8 10 -5 | 3,00 4,17 |
| Иодная (мета) | HIO4 | 2,3 10 -2 | 1,64 |
| Иодная (орто) | H5IO6 | (I)3,09 10 -2 (II)7,08 10 -9 (III)2,5 10 -13 | 1,51 8,15 12,60 |
| Иодноватая | HIO3 | 1,7 10 -1 | 0,77 |
| Иодноватистая | HIO | 3,16 10 -11 | 10,5 |
| Иодоводородная | HI | 10 11 | -11,00 |
| Ксеноновая (пер) | H4XeO6 | (III)1 10 -11 | |
| Кремнивая (мета) | H2SiO3 | (I)2,2 10 -10 (II)1,6 10 -12 | 9,66 11,80 |
| Название | Формула | Кa | рКa |
| Кремневая (орто) | H4SiO4 | (I)2 10 -10 (II)2 10 -12 (III)10 -12 (IV)10 -12 | 9,70 11,70 12,00 12,00 |
| Марганцовая | HMnO4 | 2 10 2 | -2,30 |
| Марганцовистая | H2MnO4 | (I) 10 -1 | 1,00 |
| (II) 7,1 10 -11 | 10,15 | ||
| Мышьяковая (орто) | H3AsO4 | (I)5,89 10 -3 (II)1,05 10 -7 (III)3,89 10 -12 | 2,22 6,98 11,41 |
| Мышьяковистая (мета) | HAsO2 | 6 10 -10 | 9,20 |
| Мышьяковистая (орто) | H3AsO3 | (I)6 10 -10 (II)1,7 10 -14 | 9,20 13,77 |
| Оловянистая | H2SnO2 | 6 10 -18 | 17,20 |
| Оловянная | H2SnO3 | 4 10 -10 | 9,40 |
| Роданистоводородная | HSCN | 1,4 10 -1 | 0,85 |
| Свинцовистая | H2PbO2 | 2 10 -16 | 15,70 |
| Селенистая | H2SeO3 | (I)3,5 10 -3 (II)5 10 -8 | 2,46 7,30 |
| Селеновая | H2SeO4 | (I)10 3 (II)1,2 10 -2 | -3,00 1,90 |
| Селеноводородная | H2Se | (I)1,7 10 -4 (II)10 -11 | 3,77 11,00 |
| Серная | H2SO4 | (I)10 3 (II)1,2 10 -2 | -3,00 1,90 |
| Сернистая | H2SO3 | (I)1,58 10 -2 (II)6,31 10 -8 | 1,80 7,20 |
| Сероводородная | H2S | (I)6 10 -8 (II)10 -14 | 7,20 14,00 |
| Сурьмянистая (орто) | H3SbO4 | 4 10 -5 | 4,40 |
| Сурьмянистая (мета) | HSbO2 | 10 -11 | 11,00 |
| Теллуристая | H2TeO3 | (I)3 10 -3 (II)2 10 -8 | 2,50 7,70 |
| Теллуровая | H2TeO4 | (I)2,29 10 -8 (II)6,46 10 -12 | 7,64 11,19 |
| Название | Формула | Кa | рКa |
| Теллуроводородная | H2Te | 10 -3 | 3,00 |
| Тиосерная | H2S2O3 | (I)2,2 10 -1 (II)2,8 10 -2 | 0,66 1,56 |
| Угольная (истинная) | H2CO3 | 1,32 10 -4 | 3,88 |
| Угольная(кажущаяся) | H2CO3 | (I)4,45 10 -7 (II)4,69 10 -11 | 6,35 10,33 |
| Фосфористая (орто) | H3PO3 | (I)1,6 10 -3 (II)6,3 10 -7 | 1,80 6,20 |
| Фосфорная (орто) | H3PO4 | (I)7,52 10 -3 (II)6,31 10 -8 (III)1,26 10 -12 | 2,12 7,20 11,9 |
| Фосфорноватистая | H3PO2 | 7,9 10 -2 | 1,10 |
| Фтороводородная | HF | 6,61 10 -4 | 3,18 |
| Пирофосфорная | H4P2O7 | (I)1,4 10 -1 (II)1,1 10 -2 (III)2,1 10 -7 (IV)4,1 10 -10 | 0,85 1,95 6,68 9,39 |
| Хлорноватистая | HCIO | 5,01 10 -8 | 7,30 |
| Хлористая | HC1O2 | 1,1 10 -2 | 1,97 |
| Хлороводородная | HC1 | 10 7 | -7,00 |
| Хромовая | H2CrO4 | (I)10 (II)3,16 10 -7 | -1,00 6,50 |
| Циановодородная | HCN | 7,9 10 -10 | 9,10 |
| Циановая | HOCN | 3,47 10 -4 | 3,46 |
| Тиоциановая | HSCN | 1,4 10 -1 | 0,85 |
Константы диссоциации некоторых органических кислот
| Название | Формула | Кa | рКa |
| Аминоуксусная(глицин) | NH2CH2COOH | 1,7 10 -10 | 9,78 |
| Бензойная | C6H5COOH | 6,6 10 -5 | 4,18 |
| Валерьяновая | CH3(CH3)3COOH | 1,4 10 -5 | 4,86 |
| Изовалерьяновая | (CH3)2CHCH2COOH | 1,7 10 -5 | 4,78 |
| Винная | С4О6Н6 | 9,1 10 -4 | 3,04 |
| Дихлоруксусная | CHC12COOH | 5 10 -2 | 1,30 |
| Название | Формула | Кa | рКa |
| Коричная | C6H5CH=CHCOOH | 3,7 10 -5 | 4,43 |
| Лимонная | H|OOCCH2C(OH)(COOH)CH2COOH | (I)8,5 10 -4 (II)1,8 10 -5 (III)4 10 -7 | 3,07 4,75 6,40 |
| Малеиновая | HOOCCH=CHCOOH | (I)1,2 10 -2 (II)5,9 10 -7 | 1,92 6,23 |
| Малоновая | HOOCCH2COOH | (I)1,4 10 -3 (II)2,2 10 -6 | 2,85 5,66 |
| Масляная | CH3CH2CH2COOH | 1,5 10 -5 | 4,82 |
| Миндальная | C6H5CH(OH)COOH | 1,4 10 -5 | 4,86 |
| Молочная | CH3CH(OH)COOH | 1,37 10 -4 | 3,86 |
| Муравьиная | HCOOH | 1,8 10 -4 | 3,75 |
| о-нитробензойная | NO2C6H4COOH | 6,0 10 -3 | 2,22 |
| Пикриновая | HOC6H2(NO2)3 | 5 10 -3 | 2,3 |
| Пирокатехин | C6H4(OH)2(1,2) | 3,6 10 -10 | 9,45 |
| Пропионовая | CH3CH2COOH | 1,35 10 -5 | 4,87 |
| Салициловая | C6H4(OH)COOH | 1,1 10 -3 | 2,97 |
| Сульфаминовая | H2NSO3H | 1,05 10 -1 | 0,98 |
| Сульфаниловая | H2NC6H4SO3H | 6,3 10 -4 | 3,20 |
| Сульфосалициловая | C6H3(COOH)SO3H | (II)1,4 10 -3 (III)1,8 10 -12 | 2,86 11,74 |
| Трихлоруксусная | CC13COOH | 2 10 -1 | 0,70 |
| Уксусная | CH3COOH | 1,74 10 -5 | 4,76 |
| Фенол | C6H5OH | 1,3 10 -10 | 9,90 |
| Хлоруксусная | CH2C1COOH | 1,4 10 -3 | 2,86 |
| Щавеливая | H2C2O4 | (I)5,6 10 -2 (II)5,4 10 -5 | 1,25 4,27 |
| Этилендиаминтетрауксусная | (CH2)6N2(COOH)4 | (I)10 -2 (II)2,1 10 -3 (III)6,9 10 -7 (IV)5,5 10 -11 | 1,99 2,67 6,16 10,26 |
| Яблочная | HOOCCH(OH)CH2COOH | (I)3,5 10 -4 (II)8,9 10 -6 | 3,46 5,05 |
| Янтарная | HOOCCH2CH2COOH | (I)6,5 10 -5 (II)3,3 10 -6 | 4,19 5,48 |
Константа диссоциации воды
Приводятся значения термодинамической константы при нормальном атмосферном давлении (101,325кПа). В качестве стандартного состояния принята чистая вода при соответствующей температуре. В разбавленныз растворах (а(Н2О)
1) Кω приближенно равна ионному произведению воды:Кω=[Н + ][ОН —
| T 0 C | Kω 10 -14 | -lgKω | √Kω 10 -7 |
| 0,113 | 14,943 | 0,337 | |
| 0,184 | 14,733 | 0,430 | |
| 0,291 | 14,534 | 0,540 | |
| 0,450 | 14,346 | 0,671 | |
| 0,681 | 14,166 | 0,825 | |
| 1,000 | 13,996 | 1,000 | |
| 1,460 | 13,833 | 1,210 | |
| 2,080 | 13,681 | 1,450 | |
| 2,910 | 13,534 | 1,710 | |
| 4,010 | 13,396 | 2,000 | |
| 5,470 | 13,261 | 2,340 | |
| 7,290 | 13,136 | 2,700 | |
| 9,610 | 13,017 | 3,100 | |
| 12,600 | 12,900 | 3,540 | |
| 15,800 | 12,800 | 3,980 | |
| 20,400 | 12,690 | 4,520 | |
| 25,100 | 12,600 | 5,010 | |
| 30,900 | 12,510 | 5,560 | |
| 38,000 | 12,420 | 6,170 | |
| 47,700 | 12,340 | 6,760 | |
| 55,000 | 12,260 | 7,410 |
Давление насыщенного водяного пара в равновесии с водой.
Если газ собирают над водой, то в этом случае из показания барометра надо вычесть давление водяных паров при данной температуре: Р0=Рt-Рв.
Величина Рв — давление паров воды при соответствующей температуре газа над водой, приведено в таблице:
| Температура 0 С | Двление мм.рт.ст | Температура 0 С | Двление мм.рт.ст |
| 6,50 | 17,5 | ||
| 7,00 | 18,7 | ||
| 7,50 | 19,8 | ||
| 8,00 | 21,1 | ||
| 8,60 | 22,4 | ||
| 9,20 | 23,8 | ||
| 9,80 | 25,2 | ||
| 10,50 | 26,7 | ||
| 11,20 | 28,3 | ||
| 12,00 | 30,0 | ||
| 12,80 | 31,8 | ||
| 13,60 | 33,7 | ||
| 14,50 | 35,7 | ||
| 15,50 | 37,7 | ||
| 16,50 | 39,9 |
Плотность воды при различной температуре
| Т 0 С | ρ г/см 3 |
| 0,9991 | |
| 0,9989 | |
| 0,9988 | |
| 0,9986 | |
| 0,9984 | |
| 0,9982 | |
| 0,9980 | |
| 0,9978 | |
| 0,9975 | |
| 0,9973 | |
| 0,9970 |
Для пересчета плотности в единицы кг/м 3 нужно приведенные в таблице числа умножить на 10 3 .
Плотности и концентрации некоторых
Неорганических веществ
Растворов азотной кислоты
| Плотность при 20 0 С г/см 3 | Концентрация HNO3 | Плотность при 20 0 С г/см 3 | Концентрация HNO3 | ||
| % по массе | моль/л | % по массе | моль/л | ||
| 1,000 | 0,3333 | 0,05231 | 1,140 | 23,94 | 4,330 |
| 1,005 | 1,255 | 0,2001 | 1,145 | 24,71 | 4,489 |
| 1,010 | 2,164 | 0,3468 | 1,150 | 25,48 | 4,649 |
| 1,015 | 3,073 | 0,4950 | 1,155 | 26,24 | 4,810 |
| 1,020 | 3,982 | 0,6445 | 1,160 | 27,00 | 4,970 |
| 1,025 | 4,883 | 0,7943 | 1,165 | 27,76 | 5,132 |
| 1,030 | 5,784 | 0,9454 | 1,170 | 28,51 | 5,293 |
| 1,035 | 6,661 | 1,094 | 1,175 | 29,25 | 5,455 |
| 1,040 | 7,530 | 1,243 | 1,180 | 30,00 | 5,618 |
| 1,045 | 8,398 | 1,393 | 1,185 | 30,74 | 5,780 |
| 1,050 | 9,259 | 1,543 | 1,190 | 31,47 | 5,943 |
| 1,055 | 10,12 | 1,694 | 1,195 | 32,21 | 6,107 |
| 1,060 | 10,97 | 1,845 | 1,200 | 32,94 | 6,273 |
| 1,065 | 11,81 | 1,997 | 1,205 | 33,68 | 6,440 |
| 1,070 | 12,65 | 2,148 | 1,210 | 34,41 | 6,607 |
| 1,075 | 13,48 | 2,301 | 1,215 | 35,16 | 6,778 |
| 1,080 | 14,31 | 2,453 | 1,220 | 35,93 | 6,956 |
| 1,085 | 15,13 | 2,605 | 1,225 | 36,70 | 7,135 |
| 1,090 | 15,95 | 2,759 | 1,230 | 37,48 | 7,315 |
| 1,095 | 16,76 | 2,913 | 1,235 | 38,25 | 7,497 |
| 1,100 | 17,58 | 3,068 | 1,240 | 39,02 | 7,679 |
| 1,105 | 18,39 | 3,224 | 1,245 | 39,80 | 7,863 |
| 1,110 | 19,13 | 3,381 | 1,250 | 40,58 | 8,049 |
| 1,115 | 20,00 | 3,539 | 1,255 | 41,36 | 8,237 |
| 1,120 | 20,79 | 3,696 | 1,260 | 42,14 | 8,426 |
| 1,125 | 21,59 | 3,854 | 1,265 | 42,92 | 8,616 |
| 1,130 | 22,38 | 4,012 | 1,270 | 43,70 | 8,808 |
| 1,135 | 23,16 | 4,171 | 1,275 | 44,48 | 9,001 |
| Плотность при 20 0 С г/см 3 | Концентрация HNO3 | Плотность при 20 0 С г/см 3 | Концентрация HNO3 | ||
| % по массе | моль/л | % по массе | моль/л | ||
| 1,280 | 45,27 | 9,195 | 1,420 | 71,63 | 16,14 |
| 1,285 | 46,06 | 9,394 | 1,425 | 72,86 | 16,47 |
| 1,290 | 46,85 | 9,590 | 1,430 | 74,09 | 16,81 |
| 1,295 | 47,63 | 9,789 | 1,435 | 75,35 | 17,16 |
| 1,300 | 48,42 | 9,990 | 1,440 | 76,71 | 17,53 |
| 1,305 | 49,21 | 10,19 | 1,445 | 78,07 | 17,90 |
| 1,310 | 50,00 | 10,39 | 1,450 | 79,43 | 18,28 |
| 1,315 | 50,85 | 10,61 | 1,455 | 80,88 | 18,68 |
| 1,320 | 51,71 | 10,83 | 1,460 | 82,39 | 19,09 |
| 1,325 | 52,56 | 11,05 | 1,465 | 83,91 | 19,51 |
| 1,330 | 53,41 | 11,27 | 1,470 | 85,50 | 19,95 |
| 1,335 | 54,27 | 11,49 | 1,475 | 87,29 | 20,43 |
| 1,340 | 55,13 | 11,72 | 1,485 | 91,13 | 21,48 |
| 1,345 | 56,04 | 11,96 | 1,490 | 93,49 | 22,11 |
| 1,350 | 56,95 | 12,20 | 1,495 | 95,46 | 22,65 |
| 1,355 | 57,87 | 12,44 | 1,500 | 96,73 | 23,02 |
| 1,360 | 58,78 | 12,68 | 1,501 | 96,98 | 23,10 |
| 1,365 | 59,69 | 12,93 | 1,502 | 97,23 | 23,18 |
| 1,370 | 60,67 | 13,19 | 1,503 | 97,49 | 23,25 |
| 1,375 | 61,69 | 13,46 | 1,504 | 97,74 | 23,33 |
| 1,380 | 62,70 | 13,73 | 1,505 | 97,99 | 23,40 |
| 1,385 | 63,72 | 14,01 | 1,506 | 98,25 | 23,48 |
| 1,390 | 64,74 | 14,29 | 1,507 | 98,50 | 23,56 |
| 1,395 | 65,84 | 14,57 | 1,508 | 98,76 | 23,63 |
| 1,400 | 66,97 | 14,88 | 1,509 | 99,01 | 23,71 |
| 1,405 | 68,10 | 15,18 | 1,510 | 99,26 | 23,79 |
| 1,410 | 69,23 | 15,49 | 1,512 | 99,77 | 23,94 |
| 1,415 | 70,39 | 15,81 | 1,513 | 100,00 | 24,01 |
Растворов серной кислоты
| Плотность при 20 0 С г/см 3 | Концентрация H2SO4 | Плотность при 20 0 С г/см 3 | Концентрация H2SO4 | ||
| % по массе | моль/л | % по массе | моль/л | ||
| 1,000 | 0,2609 | 0,0266 | 1,160 | 22,67 | 2,681 |
| 1,005 | 0,9855 | 0,1010 | 1,170 | 23,95 | 2,857 |
| 1,010 | 1,731 | 0,1783 | 1,175 | 24,58 | 2,945 |
| 1,015 | 2,485 | 0,2595 | 1,185 | 25,84 | 3,122 |
| 1,020 | 3,242 | 0,3372 | 1,190 | 26,47 | 3,211 |
| 1,025 | 4,000 | 0,4180 | 1,195 | 27,10 | 3,302 |
| 1,030 | 4,746 | 0,4983 | 1,200 | 27,72 | 3,391 |
| 1,035 | 5,493 | 0,5796 | 1,220 | 30,18 | 3,754 |
| 1,040 | 6,237 | 0,6613 | 1,225 | 30,79 | 3,846 |
| 1,045 | 6,956 | 0,7411 | 1,230 | 31,40 | 3,938 |
| 1,050 | 7,704 | 0,8250 | 1,235 | 32,01 | 4,031 |
| 1,055 | 8,415 | 0,9054 | 1,240 | 32,61 | 4,123 |
| 1,060 | 9,129 | 0,9865 | 1,250 | 33,82 | 4,310 |
| 1,065 | 9,843 | 1,066 | 1,255 | 34,42 | 4,404 |
| 1,070 | 10,56 | 1,152 | 1,260 | 35,01 | 4,498 |
| 1,075 | 11,26 | 1,235 | 1,265 | 35,60 | 4,592 |
| 1,080 | 11,96 | 1,317 | 1,270 | 30,19 | 4,686 |
| 1,085 | 12,66 | 1,401 | 1,275 | 36,78 | 4,781 |
| 1,090 | 13,36 | 1,484 | 1,280 | 37,36 | 4,876 |
| 1,095 | 14,04 | 1,567 | 1,285 | 37,95 | 4,972 |
| 1,100 | 14,73 | 1,652 | 1,290 | 38,53 | 5,068 |
| 1,105 | 15,41 | 1,735 | 1,295 | 39,10 | 5,163 |
| 1,110 | 16,08 | 1,820 | 1,305 | 40,25 | 5,356 |
| 1,115 | 16,76 | 1,905 | 1,310 | 40,82 | 5,452 |
| 1,120 | 17,43 | 1,990 | 1,315 | 41,39 | 5,549 |
| 1,125 | 18,09 | 2,075 | 1,320 | 41,95 | 5,646 |
| 1,130 | 18,76 | 2,161 | 1,330 | 43,07 | 5,840 |
| 1,135 | 19,42 | 2,247 | 1,335 | 43,62 | 5,938 |
| 1,145 | 20,73 | 2,420 | 1,345 | 44,72 | 6,132 |
| 1,150 | 21,38 | 2,507 | 1,350 | 45,26 | 6,229 |
| 1,155 | 22,03 | 2,594 | 1,355 | 45,80 | 6,327 |
| Плотность при 20 0 С г/см 3 | Концентрация H2SO4 | Плотность при 20 0 С г/см 3 | Концентрация H2SO4 | ||
| % по массе | моль/л | % по массе | моль/л | ||
| 1,360 | 46,33 | 6,424 | 1,545 | 64,26 | 10,12 |
| 1,380 | 48,45 | 6,817 | 1,550 | 64,71 | 10,23 |
| 1,385 | 48,97 | 6,915 | 1,555 | 65,15 | 10,33 |
| 1,390 | 49,48 | 7,012 | 1,565 | 66,03 | 10,54 |
| 1,395 | 19,50 | 7,110 | 1,570 | 66,47 | 10,64 |
| 1,400 | 50,01 | 7,208 | 1,575 | 66,91 | 10,74 |
| 1,410 | 51,86 | 7,406 | 1,580 | 67,35 | 10,85 |
| 1,415 | 52,02 | 7,505 | 1,585 | 67,79 | 10,96 |
| 1,420 | 52,51 | 7,603 | 1,590 | 68,23 | 11,06 |
| 1,425 | 53,01 | 7,702 | 1,595 | 68,66 | 11,16 |
| 1,430 | 53,50 | 1,600 | 69,09 | 11,27 | |
| 1,435 | 54,00 | 7,901 | 1,605 | 69,53 | 11,38 |
| 1,440 | 54,49 | 8,000 | 1,610 | 69,96 | 11,48 |
| 1,445 | 54,97 | 8,099 | 1,615 | 70,39 | 11,59 |
| 1,450 | 55,45 | 8,198 | 1,620 | 70,82 | 11,70 |
| 1,455 | 55,93 | 8,297 | 1,625 | 71,25 | 11,80 |
| 1,460 | 56,41 | 8,397 | 1,630 | 71,67 | 11,91 |
| 1,465 | 56,89 | 8,497 | 1,635 | 72,09 | 12,02 |
| 1,470 | 57,36 | 8,598 | 1,640 | 72,52 | 12,13 |
| 1,475 | 57,84 | 8,699 | 1,645 | 72,95 | 12,24 |
| 1,480 | 58,31 | 8,799 | 1,655 | 73,80 | 12,45 |
| 1,490 | 59,24 | 9,000 | 1,660 | 74,22 | 12,56 |
| 1,495 | 59,70 | 9,100 | 1,665 | 74,64 | 12,67 |
| 1,500 | 60,17 | 9,202 | 1,670 | 75,07 | 12,78 |
| 1,505 | 50,62 | 9,303 | 1,675 | 75,49 | 12,89 |
| 1,510 | 61,08 | 9,404 | 1,680 | 75,92 | 13,00 |
| 1,515 | 61,54 | 9,506 | 1,685 | 76,34 | 13,12 |
| 1,520 | 62,00 | 9,608 | 1,690 | 76,77 | 13,23 |
| 1,525 | 62,45 | 9,711 | 1,695 | 77,20 | 13,34 |
| 1,530 | 62,91 | 9,813 | 1,700 | 77,63 | 13,46 |
| 1,535 | 63,36 | 9,916 | 1,705 | 78,06 | 13,57 |
| 1,540 | 63,81 | 10,02 | 1,710 | 78,49 | 13,69 |
| Плотность при 20 0 С г/см 3 | Концентрация H2SO4 | Плотность при 20 0 С г/см 3 | Концентрация H2SO4 | ||
| % по массе | моль/л | % по массе | моль/л | ||
| 1,715 | 78,93 | 13,80 | 1,810 | 89,23 | 16,47 |
| 1,720 | 79,37 | 13,92 | 1,815 | 90,12 | 16,68 |
| 1,730 | 80,25 | 14,16 | 1,820 | 91,11 | 16,91 |
| 1,735 | 80,70 | 14,28 | 1,821 | 91,33 | 16,96 |
| 1,740 | 81,16 | 14,40 | 1,822 | 91,56 | 17,01 |
| 1,745 | 81,62 | 14,52 | 1,823 | 91,78 | 17,06 |
| 1,750 | 82,09 | 14,65 | 1,824 | 92,00 | 17,11 |
| 1,755 | 82,57 | 14,78 | 1,825 | 92,25 | 17,17 |
| 1,760 | 83,06 | 14,90 | 1,826 | 92,51 | 17,22 |
| 1,765 | 83,57 | 15,04 | 1,827 | 92,77 | 17,28 |
| 1,770 | 84,08 | 15,17 | 1,828 | 93,03 | 17,34 |
| 1,775 | 84,61 | 15,31 | 1,829 | 93,33 | 17,40 |
| 1,780 | 85,16 | 15,46 | 1,830 | 93,94 | 17,47 |
| 1,785 | 85,74 | 15,61 | 1,831 | 93,94 | 17,54 |
| 1,790 | 86,35 | 15,76 | 1,832 | 94,32 | 17,62 |
| 1,795 | 86,99 | 15,92 | 1,833 | 94,72 | 17,70 |
| 1,800 | 87,69 | 16,09 | 1,834 | 95,12 | 17,79 |
| 1,805 | 88,43 | 16,27 | 1,835 | 95,70 | 17,92 |
Растворов соляной кислоты
| Плотность при 20 0 С г/см 3 | Концентрация HCl | Плотность при 20 0 С г/см 3 | Концентрация HCl | ||
| % по массе | моль/л | % по массе | моль/л | ||
| 1,000 | 0,3600 | 0,09872 | 1,100 | 20,39 | 6,150 |
| 1,005 | 1,360 | 0,3748 | 1,110 | 22,33 | 6,796 |
| 1,010 | 2,364 | 0,6547 | 1,115 | 23,29 | 7,122 |
| 1,015 | 3,374 | 0,9391 | 1,120 | 24,25 | 7,449 |
| 1,020 | 4,388 | 1,227 | 1,125 | 25,22 | 7,782 |
| 1,025 | 5,408 | 1,520 | 1,130 | 26,20 | 8,118 |
| 1,030 | 6,433 | 1,817 | 1,135 | 27,18 | 8,459 |
| 1,035 | 7,464 | 2,118 | 1,140 | 28,18 | 8,809 |
| Плотность при 20 0 С г/см 3 | Концентрация HCl | Плотность при 20 0 С г/см 3 | Концентрация HCl | ||
| % по массе | моль/л | % по массе | моль/л | ||
| 1,040 | 8,490 | 2,421 | 1,150 | 30,14 | 9,505 |
| 1,045 | 9,510 | 2,725 | 1,155 | 31,14 | 9,863 |
| 1,055 | 11,52 | 3,333 | 1,160 | 32,14 | 10,22 |
| 1,060 | 12,51 | 3,638 | 1,165 | 33,16 | 10,59 |
| 1,065 | 13,50 | 3,944 | 1,170 | 34,18 | 10,97 |
| 1,070 | 14,49 | 4,253 | 1,175 | 35,20 | 11,34 |
| 1,075 | 15,48 | 4,565 | 1,180 | 36,23 | 11,73 |
| 1,080 | 16,47 | 4,878 | 1,185 | 37,27 | 12,11 |
| 1,085 | 17,45 | 5,192 | 1,190 | 38,32 | 12,50 |
| 1,090 | 18,43 | 5,509 | 1,195 | 39,37 | 12,90 |
| 1,095 | 19,41 | 5,829 | 1,198 | 40,00 | 13,14 |
Растворов уксусной кислоты
| Плотность при 20 0 С г/см 3 | Концентрация СН3СООН | Плотность при 20 0 С г/см 3 | Концентрация СН3СООН | ||
| % по массе | моль/л | % по массе | моль/л | ||
| 1,000 | 1,20 | 0,200 | 1,045 | 36,2 | 6,30 |
| 1,005 | 4,64 | 0,777 | 1,050 | 40,2 | 7,03 |
| 1,010 | 8,14 | 1,37 | 1,055 | 46,9 | 8,24 |
| 1,015 | 11,7 | 1,98 | 1,060 | 53,4 | 9,43 |
| 1,020 | 15,4 | 2,61 | 1,065 | 61,4 | 10,9 |
| 1,025 | 19,2 | 2,37 | 1,070 | 77-79 | 13,71 |
| 1,030 | 23,1 | 3,96 | 1,065 | 91,4 | 16,2 |
| 1,035 | 27,2 | 4,68 | 1,060 | 95,4 | 16,8 |
| 1,040 | 31,6 | 5,46 | 1,055 | 98,0 | 17,2 |
Растворов гидроксида калия
Источник