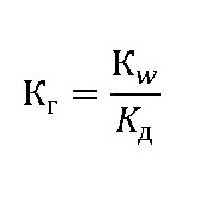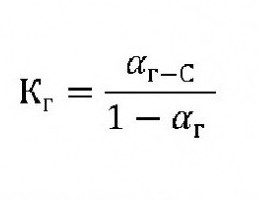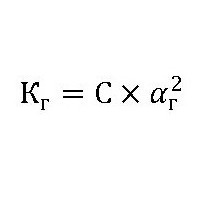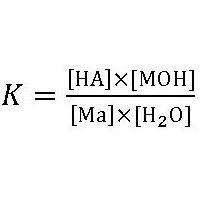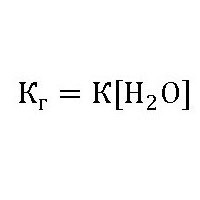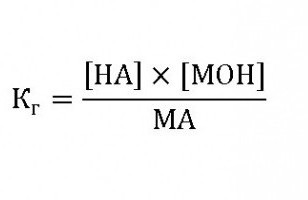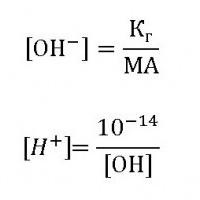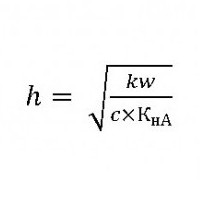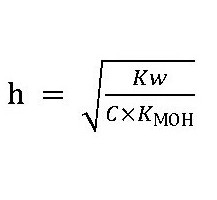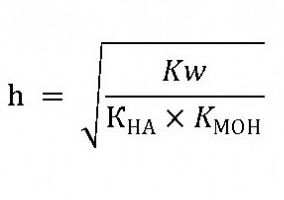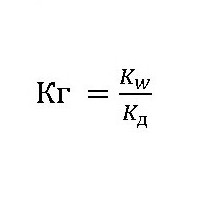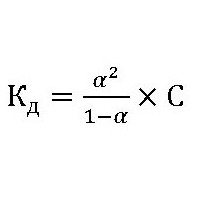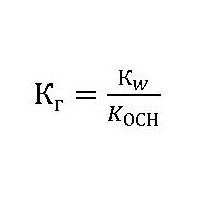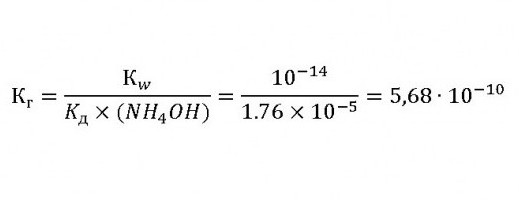- Гидролиз
- Теоретическое введение
- Примеры обратимого гидролиза
- Случаи необратимого гидролиза
- Константа и степень гидролиза
- Примеры решения задач
- Задачи для самостоятельного решения
- Степень и константа гидролиза
- Вода – универсальный растворитель
- Математический язык гидролиза
- Что такое степень гидролиза
- Константа гидролиза
- Особенности гидролиза органических соединений
- Разложение водой неорганических веществ
- Почему pH солей различен
- Степень гидролиза и ТЭД
- Вычисление константы гидролиза хлорида аммония
Гидролиз
Материалы портала onx.distant.ru
Теоретическое введение
Примеры обратимого гидролиза
Случаи необратимого гидролиза
Константа и степень гидролиза
Примеры решения задач
Задачи для самостоятельного решения
Теоретическое введение
Гидролиз – обменная реакция взаимодействия растворенного вещества (например, соли) с водой. Гидролиз происходит в тех случаях, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Примеры обратимого гидролиза
Соли, образованные сильным основанием и слабой кислотой, например , CH3COONa, Na2CO3, Na2S, KCN гидролизуются по аниону:
СН3СООNa + НОН ↔ СН3СООН + NaОН (рН > 7)
Гидролиз солей многоосновных кислот протекает ступенчато. 1 ступень:
CO3 2– + HOH ↔ HCO3 – + OH – ,
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
Соли, образованные слабым основанием и сильной кислотой, например , NH4Cl, FeCl3, Al2(SO4)3, гидролизуются по катиону:
или в молекулярной форме:
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. 1 ступень:
Fe 3+ + HOH ↔ FeOH 2+ + H + ;
FeCl3 + HOH ↔ FeOHCl2 + HCl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H + ;
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl.
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H + ;
Fe(OH)2Cl + HOH ↔ Fe(OH)3+ HCl.
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
Соли, образованные слабым основанием и слабой кислотой, например , CH3COONH4, (NH4)2CO3, HCOONH4, гидролизуются и по катиону, и по аниону:
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. Поскольку в рассматриваемом примере константы диссоциации СH3COOH и NH3·H2О при 25 о С примерно равны (Кд(СH3COOH) = 1,75·10 –5 , Кд(NH3·H2О) = 1,76·10 –5 ), то раствор соли будет нейтральным.
При гидролизе HCOONH4 реакция раствора будет слабокислой, поскольку константа диссоциации муравьиной кислоты (Кд(HCOOН) = 1,77·10 –4 ) больше константы диссоциации уксусной кислоты.
Соли, образованные сильным основанием и сильной кислотой (например, NaNO3, KCl, Na2SO4), при растворении в воде гидролизу не подвергаются.
Случаи необратимого гидролиза
Гидролиз некоторых солей, образованных слабыми основаниями и слабыми кислотами, протекает необратимо. Необратимо гидролизуется, например , сульфид алюминия:
Следует отметить, что при смешении растворов солей гидролизующихся по аниону и катиону:
Mg 2+ + HOH ↔ MgOH + + H + ,
CO3 2– + HOH ↔ HCO3 – + OH –
Продукты гидролиза первой соли усиливают гидролиз второй соли и наоборот. В результате при смешении водных растворов сульфата магния и карбоната натрия образуется основной карбонат магния:
Основные карбонаты выпадают в осадок также при смешивании растворов карбонатов щелочных металлов и солей Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.
При сливании растворов соды и солей Fe 2+ , Ca 2+ , Sr 2+ , Ba 2+ реакции протекают следующим образом:
(Ме – Fe, Ca, Sr, Ba)
При взаимодействии солей Аl 3+ , Сr 3+ и Fe 3+ в растворе с сульфидами, карбонатами и сульфитами в результате гидролиза в осадок выпадают не сульфиды, карбонаты и сульфиты этих катионов, а их гидроксиды:
Следует отметить, что катион Fe 3+ производит окисляющее действие на анион S 2- . В результате протекает реакция:
2Fe 3+ + S 2- = 2Fe 2+ + S о .
Например , хлорид железа (III) реагирует с сульфидом калия:
2FeCl3 + 3K2S = 2FeS + S + 6KCl
Некоторые соли в результате гидролиза в воде образуют малорастворимые оксосоединения:
SbCl3 + H2O → SbOCl↓ + 2HCl.
Необратимо гидролизуются в водных растворах галогенангидриды:
Константа и степень гидролиза
Константа Кг и α г степень гидролиза для растворов электролитов связаны между собой уравнением, по форме совпадающим с уравнением Оствальда:

Константа гидролиза Кг может быть рассчитана на основе значений ионного произведения воды Кw и константы диссоциации Кд образующихся в результате гидролиза слабой кислоты или слабого основания:

Примеры решения задач
Задача 1. Вычислите Кг, α г и рН 0,01 М раствора NH4Cl при температуре 298 К, если при указанной температуре Кд(NH3·H2O) = 1,76× 10 -5 .
Решение.

[Н + ] = 2,4·10 –4× 0,01 = 2,4× 10 –6 М.
рН = — lg 2,4× 10 –6 = 5,6.
Задача 2. Определите константу гидролиза, степень гидролиза и рН 0,02 М раствора НСООNa при 298 К, если при указанной температуре Кд(НСООН) = 1,77× 10 –4 .
Решение. Формиат натрия гидролизуется в соответствии с уравнением:
НСОО — + Н2О ↔ НСООН + ОН — .
Поскольку [НСООН] = [ОН – ] и [НСОО – ]·Сисх(НСООNa), то константу гидролиза можно записать следующим образом:


[Н + ] = 10 –14 ÷1,06× 10 –6 = 9,4·10 –9 М
рН = — lg 9,4× 10 –9 = 8
Задача 3. Определите рН 0,006М раствора NaNO2, если α г = 7·10 –3 %.
Решение.
[ОН – ] = 0,006× 7× 10 –5 = 4,2× 10 –7 М.
[Н + ] = 10 –14 :4,2× 10 –7 = 2,4× 10 –8 М.
рН = — lg 2,4× 10 –8 = 7,6.
Задача 5. Определите рН 0,1 М раствора Na3PO4 при 298 К, если константы диссоциации ортофосфорной кислоты при указанной температуре соответственно равны: Кд.1 = 7,11× 10 — 3 , Kд.2 = 6,34× 10 — 8 , Kд.3 = 4,40× 10 — 13 .
Решение. Na3PO4 диссоциирует в растворе и подвергается ступенчатому гидролизу:
Следует обратить внимание на выбор “нужной” величины Кд.
Kдисс.2 = 6,34·10 — 8
Так как Кг,1 > > Кг,2, то можно считать, что соль подвергается гидролизу только по первой ступени.

поскольку [HPO4 2- ] = [OH — ].
рОН = –lg 4,76× 10 — 2 = 1,32 и рН = 14 – 1,32 = 12,68.
Задачи для самостоятельного решения
1. Гидролиз соли Na2SO3 усилится при добавлении в раствор веществ:
| а) Н2O | б) Na2CO3 | в) NaOH |
| г) H2SO4 | д) Na2S | е) Na2SO4 |
2. Напишите уравнение реакции NiCl2 + Na2CO3 + H2O → .
Источник
Степень и константа гидролиза
Если рассматривать две главные отрасли химической науки, неорганическую и органическую химию, выясняется, что вы найдете у них не так уж много точек соприкосновения. Но есть один процесс истинно глобального масштаба, который объединяет неорганические и органические вещества. Это процесс гидролиза.
Вода – универсальный растворитель
Гидролиз – это взаимодействие веществ с водой, при котором составные части химических соединений образуют продукты реакции с ионами водорода и гидроксогрупп молекул H2O. Учитывая, что 79 % планеты и до 80 % от массы всех живых организмов составляет вода, становится понятно, что реакции гидролиза охватывают все проявления природных процессов, начиная разрушением горных пород и заканчивая метаболизмом на всех семи уровнях организации живой материи, начиная от молекулярного и до биосферного.
Математический язык гидролиза
Чем сложнее химический процесс, тем большего количества формул и расчетов он требует. Для обоих видов обменных реакций веществ с водой как в органической, так и в неорганической химии используют математические величины – это степень и константа гидролиза, обозначаемые как αг и Kг. Их значения вычисляют и применяют в технологических процессах органического синтеза, например, при осахаривании крахмала, гидролизе древесины, омылении жиров.
Что такое степень гидролиза
Чем быстрее вещество взаимодействует с водой, тем больше в таком растворе будет его гидролизованных молекул. Отношение их числа к общем количеству частиц химического соединения в растворе и называется степенью гидролиза. В неорганической химии её принято обозначать как h, в органической αг. Ее выражают в частях от единицы или в процентах. Например, если в воде будет растворено 2 моль вещества, а прогидролизовало 0,01 моль, то h=0,01/2=0,005 или 0,5 %.
Константа гидролиза
Эта величина показывает способность вещества гидролизоваться. Чем она выше, тем быстрее молекулы растворяемого вещества взаимодействуют с ионами водорода и гидроксильных групп воды. Её обозначают как Кг, выражение для константы гидролиза может быть представлено формулой:
где: Kw – ионное произведение воды [H + ]*[OH — ];
Kд– константа диссоциации (расщепления) растворяемого вещества.
Для органических соединений степень и константа гидролиза связаны с формулой:
Кг– константа гидролиза.
С – концентрация ионов растворенного вещества.
αг– степень гидролиза.
Особенности гидролиза органических соединений
Обменные реакции с водой у белков, углеводов и жиров протекают многоступенчато и достаточно сложно. Поэтому и константа гидролиза, формула которой:
где: С – концентрация растворенного вещества (моль/л).
αг– степень гидролиза, будет также зависеть еще и от природы катализатора (фермента), его активности и от температуры раствора.
Например, в технологическом процессе обменных реакций целлюлозы с водой специалисты просчитывают все параметры, главными из которых являются константа гидролиза и константа скорости гидролиза. Для последней величины вводят такие составляющие, как: α– относительную активность катализатора, N – его нормальность, то есть концентрацию, b – способность целлюлозы к гидролизу и λ – показатель, характеризующий зависимость скорости реакции с водой от температуры: k=α*N*b*λ
В реакциях гидролиза жиров химики-технологи учитывают её обратимость. Чтобы сдвинуть равновесие вправо, в сторону образования нужных продуктов, например, глицерина, в промышленном синтезе применяют щелочи. В этом случае гидролиз жиров проходит практически до конца: гидроксиды натрия или калия превращают многоосновные карбоновые кислоты, которые образуются в соли и таким образом препятствуют прохождению обратной реакции образования жира. Подобным способом пользуются при разложении водой сложных эфиров в реакции омыления. Увеличивая концентрацию гидроксид-ионов и разбавляя реагирующую смесь, добиваются повышения степени гидролиза α, а значит, и выхода продуктов реакции спиртов и органических кислот.
Разложение водой неорганических веществ
Практическое значение имеют реакции гидролиза химических соединений, относящихся к классу солей. Они, как известно, являются продуктами обмена между кислотами и основаниями. Так вот, их гидролиз будет зависеть как раз от того, какими именно гидроксидами и кислотами образованы соли. И ключевым здесь будет понятие теории электролитической диссоциации о силе электролитов. Константа и степень гидролиза солей также будут изменяться, в зависимости от состава ионов, образующих их молекулы.
Почему pH солей различен
Опыты показывают, что растворы различных солей могут быть кислыми (рН 7), хотя в их молекулах нет ни водородных, ни гидроксильных ионов. Объяснение этим противоречиям нужно искать в процессе их реакции с водой:
Соль+вода кислота + основание.
Этому равновесию соответствует константа гидролиза:
где: НА – кислота,
МОН – основание,
МА – соль.
Исходя из того, что концентрация воды в разбавленных растворах есть постоянной, константа гидролиза будет иметь вид:
Степень гидролиза и ТЭД
В свете теории электролитической диссоциации равновесие процесса гидролиза зависит от уже известной нам величины h или αг – степени гидролиза. Если водой разлагается соль слабой кислоты, например Na2CO3 или К2S, то
Катионы натрия не могут связать ионы ОН- в молекулы гидроксида натрия, так как он является сильным электролитом и в растворе никогда не присутствует как молекула. В то же время карбонат-ионы связываются с Н+ с образованием слабого электролита – угольной кислоты — до тех пор, пока в растворе не установится равновесие.
При гидролизе солей слабых оснований AlCl3, FeSO4:
Вычисление константы гидролиза хлорида аммония
Чтобы определить эту величину слабым основанием и сильной кислотой, используем соотношение:
Это доказывает, что при гидролизе раствор этой соли имеет кислую реакцию.
Источник