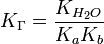Гидролиз солей. Степень и константа гидролиза



Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей:
§ 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
CO3 2− + H2O = HCO3 − + OH −
Na2CO3 + Н2О = NaHCO3 + NaOH
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
§ 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
Cu 2+ + Н2О = CuOH + + Н +
CuCl2 + Н2О = CuOHCl + HCl
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
§ 3. Гидролиз соли слабой кислоты и слабого основания:
2Al 3+ + 3S 2− + 6Н2О = 2Al(OH)3(осадок) + ЗН2S(газ)
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза — константа равновесия гидролитической реакции.
Выведем уравнение константы гидролиза соли, образованной слабой кислотой и сильным основанием:
Уравнение константы равновесия для данной реакции будет иметь вид:

Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных 
Численное значение константы гидролиза получим, используя ионное произведение воды 
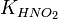
подставим в уравнение константы гидролиза равна:
В общем случае для соли, образованной слабой кислотой и сильным основанием:

для соли, образованной сильной кислотой и слабым основанием:

для соли, образованной слабой кислотой и слабым основанием:
Буферное действие – основной механизм протолитического гомеостаза в организме. Механизм действия буферных систем. Зона буферного действия и буферная ёмкость. Расчёт рН буферных систем.
Буферные системы –это растворы, обладающие способностью сохранять постоянство рН среды при разбавлении, а также при добавлении небольших количеств сильной кислоты или щелочи.
рН венозной крови 7,36
артериальной – 7,4
Буферная система состоит из донора протонов (кислоты) и акцептора (сопряжённого основания).
Наиболее распространены:
1. Слабая кислота и соль этой кислоты и сильного основания (ацетатный, гидрокарбонатный , цитратный – это с лимонной кислотой)
2. Кислая и средняя соли слабой многоосновной кислоты (фосфатный)
3. Две кислые соли слабой многоосновной кислоты (фосфатный)
4. Слабое основание и соль этого основания и сильной кислоты (аммиачный)
5. Ионы и молекулы амфолитов (белки и аминокислоты)
рН буферной смеси зависит только от соотношения компонентов и не зависит от концентрации. Протоны добавленной кислоты будут связываться с основанием, а гидроксид-анионы добавленного основания – с кислотой буф. Смеси. Предел действия ограничен количеством компонентов буферной смеси. Мерой буферного действия количественно характеризующей способность буферных систем противодействовать смещению активной реакции среды – буферная ёмкость.

Буферная ёмкость равна числу молей эквивалента сильной кислоты или сильного основания, которое нужно добавить к 1 л буф. Смеси, чтобы его рН изменился на 1.
Буф. Ёмкость зависит от:
Концентраций компонентов раствора.
Соотношения концентраций. Чем соотношение ближе к 1, тем больше ёмкость.
Вопрос
Бу́ферные систе́мы кро́ви (от англ. buffer, buff — смягчать удар) — физиологические системы и механизмы, обеспечивающие кислотно-основное равновесие в крови [1] . Они являются «первой линией защиты», препятствующей резким перепадам pH внутренней среды живых организмов.
Гемоглобиновая буферная система является основным буфером эритроцитов крови и составляет около 75% всей буферной ёмкости крови. Гемоглобин, как и другие белки, — амфолит, то есть, гемоглобиновая буферная система состоит из кислого компонента (оксигенированного Нb, т.е. НbО2) и основного компонента (неоксигенированного, т.е. восстановленного Нb). Показано, что гемоглобин — более слабая кислота (примерно в 70 раз), чем оксигемоглобин. Кроме того, Нb поддерживает постоянство рН благодаря связыванию С02 и переносу его из ткани в лёгкие и далее — во внешнюю среду.
Фосфатная буферная система представлена одно- и двузамещённым фосфорнокислым натрием (NaH2P04 и Na2HP04). Первое соединение ведёт себя как слабая кислота, второе — как слабое основание. Образовавшиеся в организме и поступившие в кровь кислоты взаимодействуют с Na2HP04, а основания — с NaH2P04. В итоге рН крови сохраняется неизменным. Фосфаты выполняют буферную роль главным образом во внутриклеточной среде (особенно клеток канальцев почек) и поддерживают исходное состояние бикарбонатного буфера.
Гемоглобиновая буферная система является основным буфером эритроцитов крови и составляет около 75% всей буферной ёмкости крови. Гемоглобин, как и другие белки, — амфолит, то есть, гемоглобиновая буферная система состоит из кислого компонента (оксигенированного Нb, т.е. НbО2) и основного компонента (неоксигенированного, т.е. восстановленного Нb). Показано, что гемоглобин — более слабая кислота (примерно в 70 раз), чем оксигемоглобин. Кроме того, Нb поддерживает постоянство рН благодаря связыванию С02 и переносу его из ткани в лёгкие и далее — во внешнюю среду.
Белковая буферная система выполняет роль внутриклеточной буферной системы. Обладая амфолитными свойствами, в кислой среде они ведут себя как основания, а в щелочной среде — как кислоты. Белковая буферная система состоит из слабодиссоциирующего белка с кислым свойствами (белок-СООН) и белка в комплексе с сильными основаниями (белок-COONa). Эта буферная система также способствует предупреждению сдвига рН крови
Важнейший показатель гомеостаза организма — концентрация ионов водорода (H+) в клетках, плазме и других внеклеточных средах. Содержание Н+ в последних влияет на конформацию макромолекул, физико-химическое и структурное состояние мембран, интенсивность образования активных форм кислорода и гидроперекисей, возбудимость, лабильность и проводимость возбудимых тканей, особенно нервных структур, чувствительность рецепторов к ФАВ, гормонам, медиаторам, сродство Нb к кислороду, активность ферментативных реакций и т.д.
Количество ионов Н+ в биологических средах организма определяет их кислотно-основное состояние (КОС), или кислотно-щелочное равновесие (КЩР), или реакцию крови. Величина КОС зависит от содержания в крови кислот, оснований и буферных систем. Интегральным показателем КОС считают величину рН, являющуюся отрицательным десятичным логарифмом молярной концентрации ионов водорода в биологической среде (например, в крови). То есть рН = -log [Н4]. Чем больше концентрация Н+ в биологической среде, тем меньше величина рН, и наоборот — чем ниже концентрация Н+ в биологической среде, тем выше величина рН.
Вопрос
Константа равновесия — Константа равновесия величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия.
Условие образования осадков непосредственно вытекает из выражения (44): если в растворе произведение реальных концентраций ионов 



Если возникает необходимость растворить осадок 
Обр костной ткани
10Ca(OH)2 + 6H3PO4 = Ca10(PO4)6(OH)2 + 18H2O
3Ca3(PO4)2 + Ca(OH)2 = 2Ca5(PO4)3OH
5CaHPO4 + 6NaOH = Ca5(PO4)3OH + 2Na3PO4 + 5H2O
Источник
Константа гидролиза
Основные понятия о константе гидролиза
В первом случае реакция чаще всего носит необратимый характер, т.е. вещество гидролизуется полностью. Из неорганических веществ гидролизу подвергаются соли: сначала происходит диссоциация на ионы, а после они взаимодействуют с молекулами воды с образованием слабого электролита. В данном случае процесс обратимый, т.е. устанавливается химическое равновесие и начинает «работать» закон действующих масс и можно записать выражение для константы равновесия, которая в данном случае будет называться константой гидролиза .
Допустим гидролизу подвергается соль состава АВ, образованная основанием АОН и кислотой НВ. Тогда уравнение гидролиза такой соли будет выглядеть следующим образом:
АВ↔ А + + В — (диссоциация соли);
А + + В — + НОН ↔АОН + НВ (ионное уравнение);
АВ+ НОН ↔АОН + НВ (молекулярное уравнение).
Выражение для константы равновесия этой реакции будет записываться:
Поскольку концентрация воды в разбавленных растворах величина постоянная Kg = K×[H2O], то выражение примет вид:
где Kg – константа гидролиза. Эта величина характеризует способность той или иной соли подвергаться гидролизу. Чем выше значение Kg, тем в большей степени протекает гидролиз.
Если соль гидролизуется по аниону, т.е. образована слабой кислотой и сильным основанием, то константа гидролиза связана с константой диссоциации кислоты:
Это означает, что, чем слабее кислота, тем сильнее её соли подвержены гидролизу.
Аналогично и для солей, гидролизующихся по катиону, т.е., образованных слабым основанием и сильной кислотой: чем слабее основание, тем в большей степени протекает гидролиз.
Примеры решения задач
| Задание | Составьте выражение для константы гидролиза карбоната натрия по первой ступени. Вычислите, если Kacid =4,8×10 -11 , а KH2O =10 -14 . |
| Решение | Карбонат натрия (Na2CO3) – соль, образованная слабой кислотой – угольной (H2CO3) и сильным основанием – гидроксидом натрия (NaOH). Гидролизуется по аниону. Среда щелочная. |
Запишем уравнение гидролиза по первой ступени:
Выражение для расчета константы равновесия будет записываться так:
А для константы гидролиза:
Рассчитаем константу гидролиза:
Kg =10 -14 / 4,8×10 -11 = 2×10 -4 .
| Задание | Запишите выражение для константы равновесия гидролиза нитрита натрия. |
| Решение | Нитрит натрия (NaNO2) – соль, образованная сильным основанием – гидроксидом натрия (NaOH) и слабой кислотой – азотистой (HNO2). Гидролизуется по аниону. Среда щелочная. |
Запишем уравнение гидролиза:
Выражение для расчета константы равновесия будет записываться так:
Источник