- Нитрат бария: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Гидролиз
- Гидролиз нитрата бериллия
- Общие сведения о гидролизе нитрата бериллия
- Гидролиз нитрата бериллия
- Примеры решения задач
- Гидролиз нитрата бария по ступенями
- Гидролиз сульфида бария
- Общие сведения о сульфиде бария
- Гидролиз сульфида бария
- Примеры решения задач
Нитрат бария: способы получения и химические свойства
Нитрат бария Ba(NO3)2 — соль металла бария и азотной кислоты. Белый, при нагревании плавится и разлагается. Хорошо растворяется в воде (гидролиза нет). Вступает в реакции обмена.
Относительная молекулярная масса Mr = 261,34; относительная плотность для тв. и ж. состояния d = 3,23; tпл = 594º C (разлагается).
Способ получения
1. Нитрат бария можно путем взаимодействия бария и разбавленной азотной кислоты, образуется нитрат бария, оксид азота (I) и вода:
если барий будет взаимодействовать с очень разбавленной азотной кислотой , то образуются нитрат бария, нитрат аммония и вода:
2. В результате взаимодействия сульфида бария и концентрированной азотной кислоты образуется нитрат бария, сера, оксид азота (IV) и вода:
Качественная реакция
Качественная реакция на нитрат бария — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат бария образует сульфат бария, нитрат меди, бурый газ оксид азота и воду:
Химические свойства
1. Hитрат бария разлагается при температуре 594 — 620º С с образованием нитрита бария и кислорода:
а если температуре поднимется до 620 — 670 о С, то на выходе реакции будут образовываться оксид бария, оксид азота (IV) и кислород:
2. Нитрат бария реагирует с простыми веществами :
2.1. Нитрат бария вступает в реакцию с атомным водородом (цинком и в присутствии соляной кислоты). В результате реакции образуется нитрат бария, хлорид цинка и вода :
3. Возможны реакции между нитратом бария и сложными веществами :
3.1. Нитрат бария вступает в реакцию с кислотами :
В результате реакции между нитратом бария и разбавленной серной кислотой образуется сульфат бария и азотная кислота:
3.2. Нитрат бария вступает в реакцию с солями :
Нитрат бария вступает в взаимодействие с гидрофосфатом натрия при кипении. В результате реакции образуется фосфат бария, нитрат натрия и азотная кислота:
Источник
Гидролиз
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.
Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
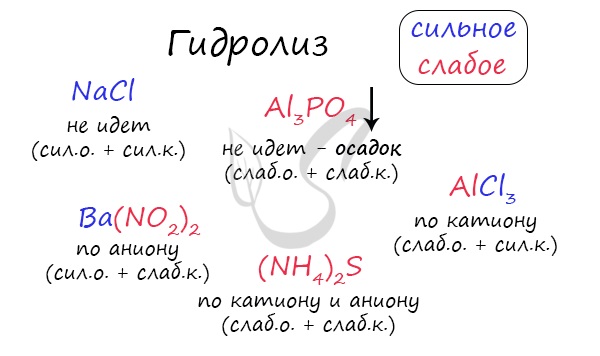
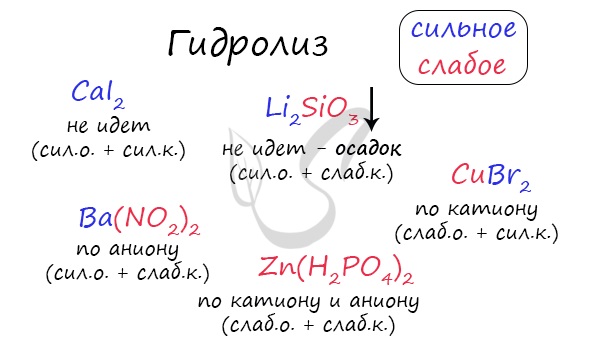
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉
По катиону, по аниону или нет гидролиза?
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
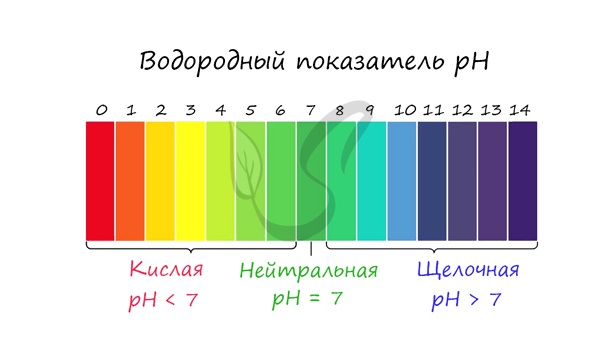
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH
Источник
Гидролиз нитрата бериллия
Общие сведения о гидролизе нитрата бериллия
Существует только в виде кристаллогидратов. Молярная масса – 133 г/моль.
Гидролиз нитрата бериллия
Гидролизуется по катиону. Характер среды – кислый. Теоретически возможна вторая ступень. Уравнение гидролиза имеет следующий вид:
Be 2+ + HOH ↔ BeOH + + H + (гидролиз по катиону);
Be 2+ + 2NO3 — + HOH ↔ BeOH + + 2NO3 — + H + (ионное уравнение);
Be(OH)NO3 ↔ BeOH + + NO3 — (диссоциация соли);
BeOH + + HOH ↔ Be(OH)2↓ + H + (гидролиз по катиону);
BeOH + + NO3 — + HOH ↔ Be(OH)2↓ + NO3 — + H + (ионное уравнение);
Примеры решения задач
| Задание | К 15%-му раствору нитрата бария массой 320 г добавили сульфат бериллия. Определите, какая масса нитрата бериллия при этом образовалась. |
| Решение | Запишем уравнение реакции взаимодействия нитрата бария с сульфатом бериллия: |
Рассчитаем массу растворенного вещества нитрата бария в растворе:
Найдем количество вещества нитрата бария (молярная масса – 261 г/моль):
Согласно уравнению реакции υ(Ba(NO3)2) = υ(Be(NO3)2) =0,18 моль. Тогда рассчитаем массу нитрата бериллия (молярная масса – 133 г/моль):
| Задание | При взаимодействии 2,5 г карбоната натрия с раствором нитрата бериллия образовался осадок карбоната бериллия. Определите массу осадка. |
| Решение | Запишем уравнение реакции взаимодействия карбоната натрия и нитрата бериллия: |
Найдем количество вещества карбоната натрия, вступившего в реакция используя данные, указанные в условии задачи (молярная масса – 106 г/моль):
Согласно уравнению реакции υ(Na2CO3) = υ(BeCO3) =0,02моль. Тогда рассчитаем массу нитрата бериллия (молярная масса – 69 г/моль):
Источник
Гидролиз нитрата бария по ступенями
Установите соответствие между названием соли и отношением этой соли к гидролизу.
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Гидролиз солей – это обменный процесс взаимодействия между ионами соли и молекулами воды, в результате которого происходит образование слабого электролита.
Если соль образована слабой кислотой и слабым основанием процесс гидролиза происходит как по катиону, так и по аниону. Гидролиз солей по такому типу протекает необратимо, т.е. полностью. Среда имеет нейтральный характер.
Если соль образована слабым основанием и сильной кислотой, то процесс называют гидролизом по катиону, если сильным основанием и слабой кислотой, то по аниону.
Если же соль образована сильным основанием и сильной кислотой, то она не гидролизуется.
Если соль не растворяется в воде, то она не гидролизуется
А) — сильное основание,
— слабая кислота, но ортофосфат кальция не растворяется в воде, поэтому
не гидролизуется.
Б) — слабое основание,
— сильная кислота, поэтому гидролиз
идет по катиону.
В) — слабое основание,
— слабая кислота, поэтому гидролиз ацетата алюминия проходит по катиону и аниону.
Г) — сильное основание,
— сильная кислота, поэтому
не гидролизуется.
Источник
Гидролиз сульфида бария
Общие сведения о сульфиде бария
Молярная масса – 169г/моль. Представляет собой бесцветные кристаллы.
Гидролиз сульфида бария
Гидролизуется по аниону. Характер среды – щелочной. Теоретически возможна вторая ступень. Уравнение гидролиза выглядит следующим образом:
BaS ↔ Ba 2+ + S 2- (диссоциация соли);
S 2- + HOH ↔ HS — + OH — (гидролиз по аниону);
Ba 2+ + S 2- + HOH ↔ HS — +Ba 2+ +OH — (уравнение в ионной форме);
2BaS +2H2O ↔ Ba(HS)2 + Ba(OH)2↓ (уравнение в молекулярной форме).
Ba(HS)2↔ Ba 2+ +2HS — (диссоциация соли);
HS — + HOH ↔H2S↑ + OH — (гидролиз по аниону);
Ba 2+ + 2HS — + HOH ↔ H2S↑ + Ba 2+ + OH — (уравнение в ионной форме);
Ba(HS)2+ 2H2O ↔ 2H2S↑ + Ba(OH)2↓ (уравнение в молекулярной форме).
Примеры решения задач
| Задание | При прокаливании 15 г сульфида бария, содержащего 7% примесей, на воздухе получили сульфат бария. Определите его массу. |
| Решение | Запишем уравнение реакции: |
Найдем массовую долю чистого (без примесей) сульфида бария:
ω(BaS) = 100% — ωimpurity = 100-7 = 93% =0,93.
Найдем массу сульфида бария, не содержащего примесей:
m(BaS) = mimpurity(BaS)×ω(BaS) = 15×0,93 = 13,95г.
Определим количество молей сульфида бария не содержащего примеси (молярная масса – 169 г/моль):
υ (BaS) = m (BaS)/ M(BaS) = 13,95/169 = 0,08моль.
Согласно уравнению υ (BaS) = υ (BaSO4) =0,08 моль. Найдем массу сульфата бария (молярная масса – 233 г/моль):
| Задание | Смесь, состоящую из 18 г сульфата бария и кокса, прокалили. В результате реакции были получены сульфид бария и угарный газ. Рассчитайте массы продуктов реакции. |
| Решение | Запишем уравнение реакции взаимодействия сульфата бария и кокса: |
BaSO4 + 2С = BaS + 4CO↑.
Найдем количество вещества сульфата бария используя данные, указанные в условии задачи (молярная масса – 233 г/моль):
υ(BaSO4) = υ (BaS) =0,08 моль;
υ(CO) = υ(BaSO4) / 4 = 0,08/4 = 0,02 моль.
Найдем массы продуктов реакции. Молярная масса сульфида бария равна 169 г/моль, угарного газа – 28 г/моль.
m(BaS)= υ(BaS)×M(BaS)= 0,08×169 = 13,52г;
m(CO)= υ(CO)×M(CO)= 0,02×28 = 0,56г.
| Понравился сайт? Расскажи друзьям! |