- Гидролиз гидрофосфата натрия
- Общие сведения о гидролизе гидрофосфата натрия
- Гидролиз гидрофосфата натрия
- Примеры решения задач
- Гидролиз h3po4 по ступеням
- Особенности гидролиза солей ортофосфорной кислоты
- Гидролиз фосфата натрия
- Общие сведения о гидролизе фосфата натрия
- Гидролиз фосфата натрия
- Примеры решения задач
- Соли фосфорной кислоты H3PO4
- Гидролиз фосфата натрия Na3PO4
- Гидролиз гидрофосфата натрия Na2HPO4
- Гидролиз дигидрофосфата натрия NaH2PO4
- Применение фосфатов
Гидролиз гидрофосфата натрия
Общие сведения о гидролизе гидрофосфата натрия
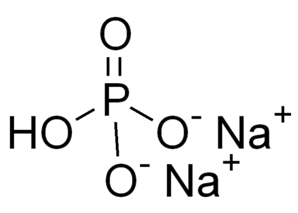
Рис. 1. Гидрофосфат натрия. Внешний вид.
Брутто-формула – Na2HPO4. Молярная масса равна гидрофосфата натрия 141,96 г/моль. Молекула имеет строение:
Хорошо растворяется в воде (гидролизуется по аниону). Образует изополисоединения.
Гидролиз гидрофосфата натрия
Гидрофосфат натрия представляет собой кислую соль, образованную слабой кислотой – фосфорной (H3PO4) и сильным основанием – гидроксидом натрия (NaOH):
Подвергается гидролизу по аниону. Характер среды водного раствора гидрофосфата натрия – щелочной. Уравнение гидролиза будет выглядеть следующим образом:
2Na + +HPO4 2- + H2O ↔ H2PO4 — + 2Na + + OH — (полное ионное уравнение);
HPO4 2- + H2O ↔ H2PO4 — + OH — (сокращенное ионное уравнение);
Теоретически возможна вторая ступень гидролиза:
Примеры решения задач
| Задание | Составьте уравнения реакций гидролиза следующих солей в молекулярной, ионной и сокращенной ионной формах: а) NaHSO3; б) NaF; в) MgCl2; г) Na2CO3; д)FeCl3. Укажите реакцию среды. |
| Ответ | Гидролизу подвергаются соли, в составе которых присутствует «слабый ион», те. Они должны быть образованы слабой кислотой и сильным основанием, сильной кислотой и слабым основанием или слабой кислотой и слабым основанием. |
Наличие гидроксид-ионов свидетельствует о щелочном характере среды.
Слабого иона нет, поскольку соль образована сильным основанием (гидроксидом натрия) и сильной кислотой (фтороводородной). Гидролизу не подвергается. Среда нейтральная.
Слабого иона нет, поскольку соль образована сильным основанием (гидроксидом магния) и сильной кислотой (хлороводородной). Гидролизу не подвергается. Среда нейтральная.
Наличие гидроксид-ионов свидетельствует о щелочном характере среды.
Fe 3+ + HOH ↔ FeOH 2+ + H + ;
Наличие ионов водорода свидетельствует о кислом характере среды.
| Задание | Установите соответствие между названием соли и отношением её к гидролизу: | ||||||||
| Ответ | а) Нитрат калия представляет собой соль, образованную сильной кислотой (азотной) и сильным основанием (гидроксидом калия): Гидролизу не подвергается. Вариант 4. б) Сульфид бария представляет собой соль, образованную слабой кислотой (сероводородной) и сильным основанием (гидроксидом бария): Подвергается гидролизу по аниону. Вариант 2. в) хлорид алюминия представляет собой соль, образованную сильной кислотой (хлороводородной) и слабым основанием (гидроксидом алюминия): Подвергается гидролизу по катиону. Вариант 1. г) карбонат натрия представляет собой соль, образованную слабой кислотой (угольной) и сильным основанием (гидроксидом натрия): Подвергается гидролизу по аниону. Вариант 2. Источник Гидролиз h3po4 по ступенямПродолжительность опыта – 3 мин. 17 сек. Опыт позволяет продемонстрировать гидролиз солей ортофосфорной кислоты в водном растворе. Фосфорная кислота трехосновная, образует три типа солей: среднюю – фосфат натрия Na3PO4 и две кислые – гидрокарбонат натрия Na2HPO4 и дигидрокарбонат натрия NaH2PO4. Гидролиз этих солей протекает в разной степени, демонстрация опыта дает возможность сравнить степень гидролиза солей. В растворе средней соли протекает только реакция гидролиза по аниону, раствор имеет щелочную среду. В растворах кислых солей протекают два конкурирующих процесса: реакция гидролиза по аниону и диссоциация аниона; для объяснения свойств необходимо сравнить степень протекания этих процессов. Для этого можно использовать значения констант равновесия. В растворе гидрофосфата: HPO4 2- + H2O HPO4 2- поскольку K1 > K2, то есть реакция гидролиза по сравнению с диссоциацией протекает в большей степени, преобладают основные свойства. В растворе дигидрофосфата: H2PO4 — + H2O H2PO4 — поскольку K1 < K2, то есть реакция гидролиза по сравнению с диссоциацией протекает в меньшей степени, преобладают кислотные свойства. Демонстрация опыта также может быть использована при изучении гидролиза солей. Источник Особенности гидролиза солей ортофосфорной кислотыОртофосфорная кислота (H3PO4) является трехосновной кислотой, поэтому может образовывать три ряда солей: средние соли – фосфаты, кислые соли – гидрофосфаты и дигидрофосфаты. Рассмотрим гидролиз (разложение водой) солей ортофосфорной кислоты. 1) Гидролиз фосфатов выражается следующим уравнением: K3PO4+HOH↔K2HPO4+KOH При гидролизе образуется гидрофосфат-ион (HPO4 2- ), который не диссоциирует на ионы. Среда определяется гидроксид-ионами (OH — ). Среда раствора сильнощелочная. 2) Гидролиз гидрофосфатов протекает по следующему уравнению: K2HPO4+HOH↔KH2PO4+KOH Образующийся дигидрофосфат-ион диссоциирует: Ионы водорода (H + ) частично нейтрализуют гидроксид-ионы (OH — ): H + + OH — ↔H2O Поэтому среда в растворе гидрофосфата является слабощелочной. 3) Гидролиз дигидрофосфатов описывается уравнением: KH2PO4+HOH↔H3PO4+ KOH (1) Но кроме гидролиза идет процесс диссоциации дигидрофосфат-ионов: H2PO4 — ↔H + +HPO4 2- (2) Поэтому все гидроксид-ионы, образовавшиеся при гидролизе нейтрализуются ионами водорода, которые образовались в процессе диссоциации дигидрофосфат-ионов. H + + OH — ↔H2O Так как реакция (2) идет в большей степени, чем реакция (1) – среда раствора дигидрофосфата слабокислая. Источник Гидролиз фосфата натрияОбщие сведения о гидролизе фосфата натрияФормула – Na3PO4. Представляет собой кристаллы белого цвета. Молярная масса – 164 г/моль. Рис. 1. Внешний вид фосфата натрия. Гидролиз фосфата натрияГидролизуется по аниону. Характер среды щелочной. Уравнение гидролиза выглядит следующим образом: 3Na + + PO4 3- + H2O ↔ HPO4 2- + OH — + 3Na + (полное ионное уравнение); PO4 3- + H2O ↔ HPO4 2- + OH — (сокращенное ионное уравнение); Теоретически возможна вторая и третья ступени: 2Na + + HPO4 2- + H2O ↔ H2PO4 — + OH — + 2Na + (полное ионное уравнение); HPO4 2- + H2O ↔ H2PO4 — + OH — (сокращенное ионное уравнение); Na + + H2PO4 — + H2O ↔ H3PO4 + OH — + Na + (полное ионное уравнение); Примеры решения задач
|

 H2PO4 — + OH —
H2PO4 — + OH —
