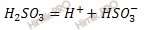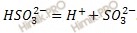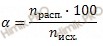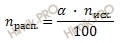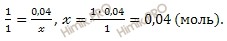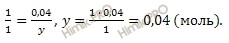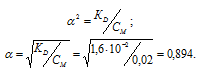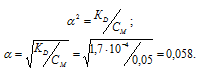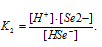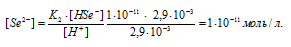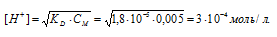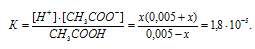Химик.ПРО – решение задач по химии бесплатно
Вычислите суммарное число моль ионов водорода (H + ) и гидросульфит-ионов (HSO3 — ), которые образуются в растворе, содержащем 0,1 моль сернистой кислоты (H2SO3). Степень диссоциации сернистой кислоты (H2SO3) в растворе по первой ступени равна 40 % (диссоциацией по второй ступени пренебречь).
Запишем уравнение диссоциации сернистой кислоты (H2SO3) по первой и второй ступени:
Первая ступень:
Учитывая, что степень диссоциации сернистой кислоты (H2SO3) в растворе по первой ступени равна 40 %, я предлагаю решить задачу, используя формулу расчета степени электролитической диссоциации:
Откуда выразим число моль электролита, распавшихся в растворе на ионы:
n (расп.) = 40 ∙ 0,1 / 100 = 0,04 (моль).
По уравнению диссоциации вычислим, сколько моль водорода (H + )и гидросульфит-ионов (HSO3 — ) образуется при диссоциации 0,04 моль сернистой кислоты (H2SO3):
при диссоциации 1 моль сернистой кислоты образуется 1 моль ионов H +
при диссоциации 4 моль сернистой кислоты образуется 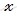
при диссоциации 1 моль сернистой кислоты образуется 1 моль HSO3 — ионов
при диссоциации 0,04 моль сернистой кислоты образуется y HSO3 — ионов
В результате получаем, что суммарное число моль ионов водорода (H + ) и сульфит-ионов (HSO3 — ) равно 0,08 моль (0,04 моль + 0,04 моль).
Ответ:
суммарное число моль ионов водорода и гидросульфит-ионов равно 0,08 моль.
Источник
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Источник
Расчет степени диссоциации сернистой кислоты и других кислот
Задача 511.
Вычислить концентрацию ионов [H + ] в 0,02М растворе сернистой кислоты. Диссоциацией кислоты во второй ступени пренебречь.
Решение:
K1(H2SO3) = 1,6 . 10 -2 .
Рассчитаем степень диссоциации кислоты по уравнению: KD = CM . 
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты, 
Концентрация иона водорода будет равна произведению степени диссоциации на концентрацию кислоты:
[H + ] = 
Ответ: 0,018 моль/л.
Задача 512. ( 3 . 10 -4 )/(1,8 . 10 -6 ) = 167
Вычислить концентрацию ионов [H + ], [HSe — ] и [Se 2- ] в 0,05 М растворе H2Se.
Решение:
Уравнение диссоциации H2Se имеет вид:
Константа диссоциации H2Se равна 1,7 . 10 4 . Рассчитаем степень диссоциации кислоты по уравнению: KD = CM . 
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты, 
Концентрация иона водорода будет равна произведению степени диссоциации на концентрацию кислоты:
[H + ] = [HSe — ] = 
Уравнение диссоциации H2Se по второй ступени имеет вид:
Тогда выражение константы диссоциации иона HSe — будет иметь вид:
Ответ: [H + ] = [HSe — ] = 2,9 . 10 -3 ; [Se 2- ] = 1 . 10 -11 .
Задача 513.
Во сколько раз уменьшится концентрация ионов водорода, если к 1 л 0,005 М раствора уксусной кислоты добавить 0,05 моля ацетата натрия?
Решение:
Исходную концентрацию ионов H + в растворе (до добавления ацетата натрия( рассчитаем по уравнению:
Концентрацию ионов водорода в растворе после добавления соли обозначим через x. Тогда, концентрация недиссоциированных молекул кислоты будет равна (0,005 –x). Концентрация ацетат-ионов будет слагаться из двух величин: из концентрации, создаваемой диссоциацией молекул кислоты (CH3COOH ⇔ CH3COO — + H + ), и концентрации, обусловленной диссоциацией в растворе соли (CH3COONa ⇔ CH3COO — + Na + ). Первая из этих величин равна x, а вторая – 0,005 моль/л; общая концентрация ионов CH3COO — равна, следовательно, (0,005 + x) моль/л. Подставив значения концентраций в выражение для константы диссоциации уксусной кислоты, получим:
Так как в присутствии одноимённых ионов CH3COO — диссоциация уксусной кислоты подавляется, то степень её диссоциации мала и значением x можно пренебречь. Тогда последнее выражение упростится, получим:
При сравнении исходной концентрации ионов водорода с рассчитанной, находим, что прибавление к раствору кислоты соли вызвало уменьшение концентрации ионов водорода в 167 раз:
( 3 . 10 -4 )/(1,8 . 10 -6 ) = 167
Источник
Электролитической диссоциации сернистой кислоты по второй ступени соответствует уравнение
§ 4. Диссоциация кислот, щелочей и солей
Электролитическую диссоциацию электролитов выражают уравнениями, как и любые другие химические реакции.
Кислоты диссоциируют на ионы водорода и ионы кислотного остатка, например;
Щелочи диссоциируют на ионы металла и ионы гидроксила, например:
Соли диссоциируют на ионы металла и ионы кислотного остатка, например:
Разберем один из приведенных примеров — электролитическую диссоциацию серной кислоты. Уравнение читается так: каждая молекула серной кислоты диссоциирует на два положительно заряженных иона водорода и ион «эс-о-четыре», несущий два отрицательных заряда. Заметим, что ионы водорода, в отличие от атомов водорода, не соединяются попарно: они не могут не только связаться друг с другом, но даже приблизиться друг к другу, так как заряжены одноименно, а одноименно заряженные тела отталкиваются.
Уравнение изображает диссоциацию серной кислоты суммарно. По существу же диссоциация многоосновных кислот является ступенчатой. Ионы водорода отщепляются от молекул кислоты не одновременно, а последовательно, один за другим:
Так как молекула или кристалл любого вещества в целом электронейтральны, общая сумма зарядов положительно заряженных ионов, образующихся при диссоциации, всегда равна общей сумме зарядов отрицательно заряженных ионов.
- Что показывают уравнения: a) NaCl = Na + + Cl — ; б) Na + + Cl — = NaCl? А Как осуществить ту и другую реакцию в домашних условиях?
- Напишите уравнение электролитической диссоциации в растворах следующих веществ: а) иодистоводородной кислоты, б) селеновой кислоты H2SeO4, в) гидроокиси лития, г) гидроокиси бария Ва(ОН)2, д) нитрата меди (II) Cu(NO3)2, e) сульфата железа (III), ж) сульфида натрия, з) бисульфата натрия NaHSO4 (если известно, что его раствор окрашивает лакмус в красный цвет). Проверьте, одинаковы ли суммы зарядов положительно и отрицательно заряженных ионов. Прочтите первые два уравнения.
- Напишите уравнения трех последовательных ступеней диссоциации фосфорной кислоты Н3РO4. Проверьте, одинаковы ли суммы зарядов положительно и отрицательно заряженных ионов.
Источник
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Источник