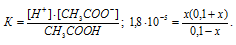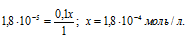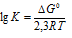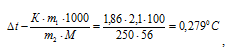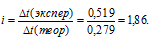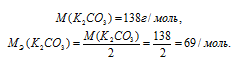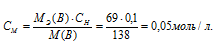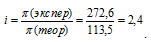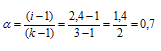Напишите реакции ступенчатой диссоциации ортофосфорной кислоты:
Напишите реакции ступенчатой диссоциации ортофосфорной кислоты:
Решение: трехосновная ортофосфорная кислота H3PO4 диссоциирует следующим образом:
Константа диссоциации K д
Степень диссоциации α
Важное значение имеет диссоциация воды, поскольку, являясь слабым электролитом и обычным растворителем, она участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:
ее константа при 298 K равна:
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной:
Отсюда произведение постоянных величин:
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды Kв, равна:
Таким образом, в пределах 15–25 °C ионное произведение воды Kв = 10–14.
Равенство [H+] и [OH–] соответствует нейтральной среде:
при [H+] > 1 ∙ 10–7 – кислой,
при [H+] 7 соответствует щелочной среде, pH = 7 – нейтральной среде.
Поскольку pH + pOH = 14, можно видеть, что pH может меняться от небольших отрицательных значений до величин, немного превышающих 14 (pH NaOH c C = 2 равен 14,3).
Источник
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Источник
Лекция 18. Кривая титрования ортофосфорной кислоты
Ключевые слова: многоосновные кислоты, кривая титрования ортофосфорной кислоты.
Многоосновные кислоты можно рассматривать как смесь двух и более кислот, значительно различающихся по силе, поскольку К1 > К2 > К3.
Раздельные скачки на кривых титрования многоосновных кислот наблюдаются в том случае, если отношение двух констант диссоциации не менее 10 4 . Если отношение констант намного меньше указанного, изменение рН в первой точке эквивалентности будет слишком мало и этот скачок нельзя использовать для точных определений. Например, так как
для точного определения щавелевой кислоты можно использовать только вторую точку эквивалентности. Щавелевая кислота титруется щелочью по двум стадиям в присутствии фенолфталеина:
Ортофосфорная кислота является трехосновной и диссоциирует в водном растворе по трем стадиям.
1 стадия: H3PO4 
2 стадия: H2PO4 — 
3 стадия: HPO4 2- 
Соответствующие константы диссоциации равны:
По первой стадии диссоциации ортофосфорная кислота средней силы, по второй – слабая и по третьей – очень слабая.
Нейтрализация ортофосфорной кислоты раствором щелочи протекает ступенчато – в три стадии. В соответствии с этим на кривой титрования присутствуют три точки эквивалентности и можно ожидать три скачка для каждой последовательной стадии нейтрализации кислоты. Рассмотрим кривую титрования для 100 мл 0,1М раствора ортофосфорной кислоты 0,1М раствором гидроксида натрия.
В растворе ортофосфорной кислоты рНопределяется 1-й стадией диссоциации и рассчитывается через К1H3PO4. Вторая и третья стадии диссоциации не учитываются, так как подавлены.
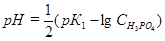
где CH3PO4 — молярная концентрация ортофосфорной кислоты.
При добавлении гидроксида натрия протекает первая стадия нейтрализации:
От начала титрования до первой точки эквивалентностиортофосфорная кислота в избытке, гидроксид натрия нейтрализует ее по первой стадии не полностью.
В растворе присутствует буферная смесь (Н3РО4 + NaH2PО4), для которой
где CNaH2PO4 — молярная концентрация дигидрофосфата натрия.
В первой точке эквивалентности вся ортофосфорная кислота оттитрована по первой стадии, в растворе присутствует только кислая соль NaH2PО4, и рН рассчитывается по соотношению
Поскольку отношение констант:
(К1H3PO4/ К2H3PO4) = (7,1·10 -3 /6,2·10 -8 ) = 10 5,06 > 10 4 и К1H3PO4 =7,1·10 -3 > 10 -7 в первой точке эквивалентностина кривой титрования присутствует скачок и возможно дифференцированное титрование ортофосфорной кислоты по первой стадии нейтрализации до дигидрофосфата.
После первой и до второй точки эквивалентности происходит нейтрализация по второй стадии:
В растворе присутствуют буферная смесь слабая «кислота» NaН2РО4 — и ее соль Na2HPО4. Значение рН раствора рассчитывается приблизительно по формуле
где CNa2HPO4 — молярная концентрация гидрофосфата натрия.
Во второй точке эквивалентности вся ортофосфорная кислота оттитрована по второй ступени и в растворе присутствует кислая соль Na2HPО4, для которой: рН(Na2HPО4) = 1/2·(рК2 + рК3) = ½(7,21 + 12,30) = 9,76.
Поскольку отношение констант:
(К2H3PO4/К3H3PO4) = (6,2∙10 -8 /5,0∙10 -13 ) = 10 5,09 > 10 4 и К2H3PO4 =6,2 10 -8 ≈ 10 -7 во второй точке эквивалентностина кривой титрования присутствует небольшой скачок и возможно дифференцированное титрование ортофосфорной кислоты по второй стадии нейтрализации до гидрофосфата.
После второй до третьей точки эквивалентности анионы НРО4 2- титруются щелочью до РО4 3- , протекает третья стадия нейтрализации в соответствии с уравнением
В растворе присутствует буферная смесь: недотитрованная очень слабая «кислота» Na2НРО4 и ее соль Na3PО4. Значение рН раствора рассчитывается приблизительно по формуле
где CNa3PO4 — молярная концентрация ортофосфата натрия.
В третьей точке эквивалентностиортофосфорная кислота полностью оттитрована по трем стадиям. В растворе присутствует ортофосфат натрия Na3PО4, который подвергается сильному гидролизу по аниону (примерно на 30%) и, следовательно:
Поскольку К3H3PO4 = 5,0 10 -13 -7 , в третьей точке эквивалентности скачок отсутствует, и оттитровать ортофосфорную кислоту по трем стадиям невозможно.
После третьей точки эквивалентности значение рН раствора определяется избытком прибавленного рабочего раствора щелочи и рассчитывается по соотношению (см. лекцию 9):
рН = 14 + lgC΄М(NaOН).
Кривая титрования 0,1М раствора ортофосфорной кислоты 0,1М раствором гидроксида натрия показана на рисунке.

Кривая титрования 0,1М раствора Н3РО4 0,1М раствором NaOH
Результаты вычислений значений рН в ходе титрования 0,1М Н3РО4 раствором 0,1М NaOH приведены в таблице:
| Добавлено 0,1 М NaOH, мл | ||||||||||
| pH | 1,72 | 2,22 | 4.15 | 4,67 | 5,21 | 7,21 | 9,21 | 9,80 | 12,3 | 12,35 |
| Характерные точки | 1-я точка экв. | 2-я точка экв. | 3-я точка экв. |
Контрольные вопросы
1.Охарактеризуйте кислотные свойства Н3РО4.
2.Сколько стадий нейтрализации ортофосфорной кислоты?
3.Сколько скачков присутствует на кривой титрования Н3РО4?
4.Возможно ли раздельное (дифференцированное) титрование ортофосфорной кислоты по 1-й стадии?
5.Возможно ли раздельное (дифференцированное) титрование ортофосфорной кислоты по двум стадиям?
6.Какие индикаторы применяют для титрования Н3РО4?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. — М.: Дрофа, 2005. — С. 144 – 147.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С. 110 — 114.
Источник
Задачи по химии на расчеты концентрации ионо и изотонических коэффициентов электролитов
Задача 514.
Рассчитать концентрацию ионов CH3COO — в растворе, 1 л которого содержит 1 моль CH3COOH и 0,1 моля НСI, считая диссоциацию последнего полной.
Решение:
KD(CH3COOH) = 1.8 . 10 -5 .
Уравнения диссоциаций кислот имеют вид:
CH3COOH ⇔ CH3COO — + H + ;
HCl⇔ Cl — + H + .
При введении в раствор слабого электролита CH3COOH раствора сильного электролита НСI (т.е. ионов H + ), одинаковых ионов, образующихся при диссоциации уксусной кислот, равновесие диссоциации последней нарушается и смещается в направлении образования недиссоциированных молекул, так что степень диссоциации слабого электролита уменьшится.
Таким образом, при прибавлении 0,1 М раствора НСI к 1 М раствору CH3COOH приведёт к повышению концентрации ионов водорода и, согласно правилу Ле Шателье, равновесие диссоциации сместится влево, в сторону увеличения концентрации молекул уксусной кислоты. Концентрацию ионов H + и CH3COO — при диссоциации CH3COOH обозначим через x моль/л. Тогда концентрация недиссоциированных молекул CH3COOH будет равна (1 – x)моль/л. Общая концентрация ионов H + будет слагаться из двух величин: из концентрации, создаваемой при диссоциации CH3COOH, и из концентрации, создаваемой при диссоциации НСI, т.е. (0,1 + x). Подставим полученные значения концентраций в выражение константы диссоциации CH3COOH, рассчитаем значение x, получим:
Поскольку в присутствии одноимённых ионов H + диссоциация уксусной кислоты подавляется, то степень её диссоциации будет ничтожно мала и поэтому значением (x) в множителях (1 – x) и (1 + x) можно пренебречь. Тогда получим выражение:
Ответ: 1,8 . 10 -4 моль/л.
Задача 515.
Исходя из значений последовательных констант диссоциации ортофосфорной кислоты, определить знак изменения энергии Гиббса для каждой из трех ступеней диссоциации. Для какой из них 
Решение:
Диссоциация трёхосновной ортофосфорной кислоты протекает в три ступени, поэтому для каждой ступени будет отвечать определённое значение константы диссоциации. Константы ступенчатых диссоциаций H3PO4 имеют следующие значения:
К1 = 7,5 . 10 -3 ; К2 = 6,3 . 10 -8 ; К3 = 1,3 . 10 -12 , т.е. К1 > K2 > K3.
Тогда из уравнения:

Все значения констант меньше единицы, значит, все значения
Ответ: Для третьей ступени.
Задача 516.
Раствор, содержащий 2,1г КОН в 250г воды, замерзает при -0,519°С. Найти для этого раствора изотонический коэффициент.
Решение:
Теперь определим понижение температуры кристаллизации 
где
m1 — масса растворённого вещества, m2 — масса раствора, М – молярная масса растворённого вещества, К – криоскопическая константа.
Сравнивая найденное значение 

Ответ: 1,86.
Задача 517.
При 0°С осмотическое давление 0,1 н. раствора карбоната калия равно 272,6 кПа. Определить кажущуюся степень диссоциации в растворе.
Решение:
Найдём молярность 0,1 н раствора К2СО3 по формуле:
По уравнению 

Теперь рассчитаем изотонический коэффициент (i) раствора, сравнив экспериментальное значение осмотического давления с теоретическим значением, получим:
Рассчитаем кажущуюся степень диссоциации (
здесь K — общее число ионов, образующихся при диссоциации электролита.
Источник