Гидролиз гидрофосфата натрия
Общие сведения о гидролизе гидрофосфата натрия
Рис. 1. Гидрофосфат натрия. Внешний вид.
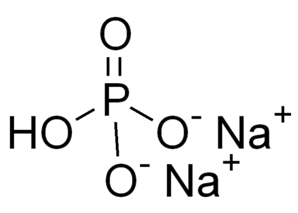
Брутто-формула – Na2HPO4. Молярная масса равна гидрофосфата натрия 141,96 г/моль. Молекула имеет строение:
Хорошо растворяется в воде (гидролизуется по аниону). Образует изополисоединения.
Гидролиз гидрофосфата натрия
Гидрофосфат натрия представляет собой кислую соль, образованную слабой кислотой – фосфорной (H3PO4) и сильным основанием – гидроксидом натрия (NaOH):
Подвергается гидролизу по аниону. Характер среды водного раствора гидрофосфата натрия – щелочной. Уравнение гидролиза будет выглядеть следующим образом:
2Na + +HPO4 2- + H2O ↔ H2PO4 — + 2Na + + OH — (полное ионное уравнение);
HPO4 2- + H2O ↔ H2PO4 — + OH — (сокращенное ионное уравнение);
Теоретически возможна вторая ступень гидролиза:
Примеры решения задач
| Задание | Составьте уравнения реакций гидролиза следующих солей в молекулярной, ионной и сокращенной ионной формах: а) NaHSO3; б) NaF; в) MgCl2; г) Na2CO3; д)FeCl3. Укажите реакцию среды. |
| Ответ | Гидролизу подвергаются соли, в составе которых присутствует «слабый ион», те. Они должны быть образованы слабой кислотой и сильным основанием, сильной кислотой и слабым основанием или слабой кислотой и слабым основанием. |
Наличие гидроксид-ионов свидетельствует о щелочном характере среды.
Слабого иона нет, поскольку соль образована сильным основанием (гидроксидом натрия) и сильной кислотой (фтороводородной). Гидролизу не подвергается. Среда нейтральная.
Слабого иона нет, поскольку соль образована сильным основанием (гидроксидом магния) и сильной кислотой (хлороводородной). Гидролизу не подвергается. Среда нейтральная.
Наличие гидроксид-ионов свидетельствует о щелочном характере среды.
Fe 3+ + HOH ↔ FeOH 2+ + H + ;
Наличие ионов водорода свидетельствует о кислом характере среды.
| Задание | Установите соответствие между названием соли и отношением её к гидролизу: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ответ | а) Нитрат калия представляет собой соль, образованную сильной кислотой (азотной) и сильным основанием (гидроксидом калия): Гидролизу не подвергается. Вариант 4. б) Сульфид бария представляет собой соль, образованную слабой кислотой (сероводородной) и сильным основанием (гидроксидом бария): Подвергается гидролизу по аниону. Вариант 2. в) хлорид алюминия представляет собой соль, образованную сильной кислотой (хлороводородной) и слабым основанием (гидроксидом алюминия): Подвергается гидролизу по катиону. Вариант 1. г) карбонат натрия представляет собой соль, образованную слабой кислотой (угольной) и сильным основанием (гидроксидом натрия): Подвергается гидролизу по аниону. Вариант 2. Источник Электролитическая диссоциацияЭлектролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом. Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом. В общем виде процесс электролитической диссоциации можно представить так: KA ⇄ K + (катион) + A — (анион) Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее. У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы. Ступени диссоциацииНекоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4. Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты: Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов. Для серной кислоты диссоциация будет выглядеть так: Для средних солей диссоциация чаще всего происходит в одну ступень: Из одной молекулы ортофосфата натрия образовалось 4 иона. Из одной молекулы сульфата калия образовалось 3 иона. Электролиты и неэлектролитыХимические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты. Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные. К ним относятся соли, сильные кислоты и щелочи (растворимые основания). Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы. Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные. К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония. Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток. Молекулярное, полное и сокращенное ионные уравненияМолекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений: Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя. © Беллевич Юрий Сергеевич 2018-2021 Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. Блиц-опрос по теме Электролитическая диссоциация Источник Диссоциация кислот, оснований, солей.Кислотами называются электролиты, при диссоциации которых образуются катионы водорода и анионы кислотных остатков. Многоосновные кислоты средней силы и слабые диссоциируют ступенчато: H2S⇄ H+S – (первая ступень) HS – ⇄S 2 – (вторая ступень) Основанияминазываются электролиты, при диссоциации которых образуются катионы металлов и анионы гидроксогрупп Если основание содержит несколько групп OH — , то может происходить ступенчатая диссоциация: Ca(OH)2 ⇄Ca(OH) + +OH — (первая ступень) Ca(OH) + ⇄Ca 2+ + OH — (вторая ступень) Уравнения полной диссоциации имеют вид: Соляминазываются электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков. Диссоциация кислых солей происходит по ступеням: 2 H2P⇄H + + HP(вторая ступень) HP⇄H + + P (третья ступень) Основные соли характерны для многовалентных металлов и диссоциируют с образованием основных и кислотных остатков. Диссоциация ионов основных остатков на ионы металла и гидроксогруппы почти не имеет места. Контрольные вопросы: 1. Какие в-ва называют электролитами, а какие – неэлектролитами? Приведите примеры 2. Дайте определение явления электролитической диссоциации. Кто автор теории электролитической диссоциации? 3. Как диссоциируют в-ва с ионной связью? 4. Как диссоциируют в-ва с ковалентной связью? 5. Какая величина характеризует способность электролита к диссоциации? 6. Чем отличается диссоциация сильных электролитов от диссоциации слабых? 7. Какие в-ва в свете теории электролитической диссоциации называют кислотами? Основаниями? Солями Тема. 1.5: Классификация неорганических соединений и их свойств Перечень изучаемых вопросов: Кислоты и их свойства. Кислоты как электролиты, их классификация по различным признакам. Химические свойства кислот в свете теории электролитической диссоциации. Особенности взаимодействия концентрированной серной и азотной кислот с металлами. Основные способы получения кислоты. Основания и их свойства. Основания как электролиты, их классификация по различным признакам. Химические свойства оснований в свете теории электролитической диссоциации. Разложение нерастворимых в воде оснований. Основные способы получения оснований. Оксиды и их свойства. Солеобразующие и несолеобразующие оксиды. Основные, амфотерные и кислотные оксиды. Зависимость характера оксида от степени окисления образующего его металла. Химические свойства оксидов. Получение оксидов. Соли и их свойства. Соли как электролиты. Соли средние, кислые и оснóвные. Химически свойства солей в свете теории электролитической диссоциации. Способы получения солей. Гидролиз солей. Кислоты и их свойства. Кислоты как электролиты, их классификация по различным признакам. Химические свойства кислот в свете теории электролитической диссоциации. Особенности взаимодействия концентрированной серной и азотной кислот с металлами. Основные способы получения кислоты. Кислотаминазываются сложные вещества, состоящие из атомов водорода и кислотных остатков.
Классификация кислот По химическому составу кислоты делятся на:
По основности кислоты делятся: Одноосновные: НCl, HNO3, HBr, диссоциирующие в одну ступень Трёхосновные: H3 PO4, H3BO3, диссоциирующие в три ступени По степени диссоциации (силе) кислоты делятся: Источник Теория электролитической диссоциацииТемы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты. Электролиты – это вещества, растворы и расплавы которых проводят электрический ток. Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов. Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы). Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении. Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы. К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой. В чем же суть процесса электролитической диссоциации? Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло? NaCl = Na + + Cl – При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H + + Cl — . При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов. Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества: Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы. Nпродисс — это число продиссоциировавших молекул, Nисх — это исходное число молекул. По степени диссоциации электролиты делят на делят на сильные и слабые. Сильные электролиты (α≈1): 1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.) 2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.; 3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2. Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1. Слабые электролиты (α 1. Слабые кислоты, в т.ч. органические; 2. Нерастворимые основания и гидроксид аммония NH4OH; 3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости). Неэлектролиты: 1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов); 2. Простые вещества; 3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.). Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты. Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– : Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота: HCO3 – ↔ H + + CO3 2– Гидроксид магния диссоциирует также в 2 ступени: Mg(OH)2 ⇄ Mg(OH) + OH – Mg(OH) + ⇄ Mg 2+ + OH – Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния: KHCO3 ⇄ K + + HCO3 – (α=1) HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1) MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы. 2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем. 3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами. 4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов. 5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита. 6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации. Примеры . 1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3 Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе: а) K2S ⇄ 2K + + S 2– , при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак; б) Ba(ClO3)2 ⇄ Ba 2+ + 2ClO3 – , опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак; в) NH4NO3 ⇄ NH4 + + NO3 – , при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак; г) Fe(NO3)3 ⇄ Fe 3+ + 3NO3 – , при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит. Источник |