Соединения фосфор
При кипячении фосфорного ангидрида с водой образуется ортофосфорная кислота. Ее часто называют просто фосфорной кислотой:
Фосфорная кислота Н3РО4 — белое кристаллическое вещество, расплывающееся на воздухе, tпл = 42,35 °С. Она не ядовита в отличие от некоторых соединений фосфора и хорошо растворима в воде. В водных растворах фосфорная кислота диссоциирует. Это электролит средней силы. Электролитическая диссоциация фосфорной кислоты протекает ступенчато:
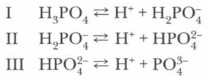
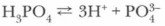
Проблема. Наиболее полно диссоциация идет по первой ступени, каждый последующий ион Н + отщепляется труднее. Почему ?
Окислительные свойства, в отличие от HNO3 и концентрированной H2SO4, фосфорная кислота не проявляет. Она также устойчива к нагреванию.
Фосфорная кислота как трехосновная способна образовывать три вида солей:

Средние соли ортофосфорной кислоты называют ортофосфатами или фосфатами.
На примере фосфата натрия подтвердите, что он обладает общими свойствами солей. Напишите ионные уравнения реакций.
Задание. Запишите уравнения реакций получения всех видов солей фосфорной кислоты при взаимодействии ее с гидроксидом натрия. Отразите их сущность сокращенными ионными уравнениями. (Ориентируйтесь по таблице растворимости!)
Фосфаты почти всех металлов в воде нерастворимы (за исключением фосфатов щелочных металлов). Дигидрофосфаты, напротив, все хорошо растворимы в воде.
Многие соли фосфорной кислоты широко применяются в сельском хозяйстве как фосфорные удобрения. В качестве минеральных удобрений используют только растворимые и хорошо усвояемые растениями соли кальция: гидро- и дигидрофосфаты.
Фосфорная кислота и ее соли в растворах проявляют общие свойства соединений их классов.
Получение Н3РО4. В лаборатории фосфорную кислоту Н3РO4 получают, окисляя фосфор 32 %-ной азотной кислотой:
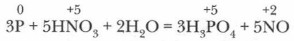
В промышленности фосфорную кислоту получают, действуя на измельченный природный фосфат кальция серной кислотой (экстракционный метод):
или электротермическим методом (восстановлением фосфатов до фосфора с последующим его сжиганием и растворением в воде оксида фосфора (V)). Этот способ более экономичен и экологичен, позволяет получать более чистый продукт. Полученная таким образом фосфорная кислота идет на производство фосфорных удобрений.
Итак, сравним свойства соединений азота и фосфора. Оксид фосфор а (V) и фосфорная кислота обладают большей устойчивостью и более слабыми кислотными свойствами по сравнению с аналогичными соединениями азота +5. Концентрированная Н3РO4 в отличие от HNO3 не обладает окислительными свойствами. Фосфин по сравнению с аммиаком является менее прочным соединением и отличается более слабыми основными свойствами. Эти примеры подтверждают закономерности изменения свойств элементов в главных подгруппах периодической системы.
Оксид фосфора (V) • Ортофосфорная кислота • Соли ортофосфорной кислоты
Вопросы и задания





Укажите условия их протекания.




Источник
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Источник
Диссоциация кислот, оснований, солей. Диссоциация воды рН-показатель.
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода
Н3РО4 
Н2РО — 4 
НРО 2- 4 
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся количествах) Н2РО 2- 4,НРО 2- 4 и РО 3- 4.
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
KOH 

Основания, растворимые в воде называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2,Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также NН4ОН. Большинство оснований в воде малорастворимо. Кислотность основания определяется числом его гидроксильных групп Например, NН4ОН — однокислотное основание, Са(ОН)2 — двухкислотное, Fе(ОН)3 -трехкислотное и т.д. Двух- и многокислотные основания диссоциируют ступенчато
Ca(ОН)2 
Ca(OH) + 
Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными илиамфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы Н + и ОН — (в незначительных количествах):
Н2O 
Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленны наличием катионов водорода Н + , и щелочные свойства,обусловленные наличием ионов ОН — .
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением
2ОН — + Zn 2+ + 2Н2О 

Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония ( NH + 4) и анионы кислотных остатков
(NH4)2SO4 

Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
KHSO4 
HSO — 4 
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
Mg(OH)Cl 
Mg(OH) + 
Основностъ кислоты определяется числом катионов водорода, которые образуются при диссоциации. Так, НCl, HNO3 — одноосновные кислоты — образуется один катион водорода ;Н2S, Н2СО3, Н2SO4 — двухосновные, а Н3РО4, Н3АsО4 — трехосновные, так как образуются соответственно два и три катиона водорода. Из четырех атомов водорода,содержащихся в молекуле уксусной кислоты СН3СООН, только один, входящий в карбоксильную группу — СООН, способен отщепляться в виде катиона Н + , -уксусная кислота одноосновная.
Двух- и многоосновные кислоты диссоциируют ступенчато (постепенно).
В насыщенном растворе твердого электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Она называется произведением растворимости.
Если молекула электролита содержит несколько одинаковых ионов, то концентрации этих ионов, согласно закону действия масс*, должны быть возведены в соответствующие степени. Например:
PbI2 
Зная произведения растворимости, можно решать вопросы, связанные с образованием или растворением осадков при химических реакциях. Например, пусть диссоциация соли АВ происходит на два иона:
АВ 
Обозначив растворимость через s (моль/л), получим [A + ]=[B – ]=s, ПР=[A + ][B – ]=s 2 . На практике чаще возникает обратная задача определения растворимости. Для соли, диссоциирующей на два иона, 
AB2 
В этом случае [A 2+ ]=s, [B – ]=2s, ПР=[A 2+ ][B – ] 2 =s·(2s) 2 =4s 3 , 
Если фактическое произведение концентраций (ПС) ионов в некотором растворе превышает значение произведения растворимости, т.е. ПС>ПР, то раствор является пересыщенным *, и из него выпадает осадок. Условие растворения осадка (ненасыщенности раствора): ПС
H2O 
Такой процесс называется автопротолизом (самодиссоциацией). По величине электропроводности чистой воды можно вычислить концентрации ионов H + и OH – . При 25°С они равны по 10 –7 моль/л.
Выражение для константы диссоциации * воды имеет вид:

В воде и разбавленных водных растворах концентрацию воды можно считать постоянной: [H2O]=55,5 моль/л, поэтому Kw – константа. Выражение, полученное для Kw, показывает, что в воде и разбавленных водных растворах при постоянной температуре произведение концентраций ионов водорода и гидроксид-ионов есть величина постоянная. Она называется ионным произведением воды. При 25°С Kw=10 –14 .
В кислых растворах больше концентрация ионов водорода, в щелочных – концентрация ионов OH – . Однако произведение этих молярныхконцентраций всегда остается постоянным. Если, например, к чистой воде добавить столько кислоты, чтобы концентрация ионов водорода повысилась до 10 –3 моль/л, то концентрация гидроксид-ионов станет равной 10 –11 моль/л. Следовательно, если известна величина [H + ], то однозначно определяется величина [OH – ]. Поэтому степень кислотности или щелочности раствора можно количественно охарактеризовать концентрацией ионов водорода:
Нейтральный раствор [H + ]=10 –7 моль/л;
кислый раствор [H + ]>10 –7 моль/л;
щелочной раствор [H + ] –7 моль/л.
Наиболее часто используют не концентрацию [H + ], а ее десятичный логарифм, взятый с обратным знаком:
Эта величина называется водородным показателем. Например, если [H + ]=10 –5 моль/л, то pH=5; если [H + ]=10 –9 моль/л, то pH=9. Отсюда следует, что в нейтральном растворе pH=7, в кислом растворе pH 7. Иногда пользуются значением гидроксидного показателя pOH=–lg[OH – ]. При 25°С выполняется равенство: pH+pOH=14.
Для многих процессов величина pH очень важна (для жизнедеятельности растений и животных – pH крови, почвенного раствора). Свойства природных вод, в частности их коррозионная активность, сильно зависят от pH.
Источник








