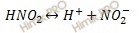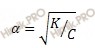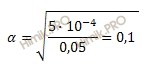Диссоциация кислот, оснований, амфотерных гидроксидов и солей в водных растворах
Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы водорода Н + . Составим уравнение электролитической диссоциации сильных кислот: а) одноосновной азотной кислоты HNО3 и б) двухосновной серной кислоты H2SO4:
Число ступеней диссоциации зависит от основности слабой кислоты Нх(Ас), где х — основность кислоты.
Пример: Составим уравнения электролитической диссоциации слабой двухосновной угольной кислоты Н2СО3.
Первая ступень диссоциации (отщепление одного иона водорода Н + ):
Константа диссоциации по первой ступени:
Вторая ступень диссоциации (отщепление иона водорода Н + от сложного иона НСО3 — ):
Растворы кислот имеют некоторые общие свойства, которые, согласно теории электролитической диссоциации, объясняются присутствием в их растворах гидратированных ионов водорода Н + (Н3О + ).
Основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН — .
Составим уравнение электролитической диссоциации однокислотного основания гидроксида калия КОН:
Сильное двухкислотное основание Ca(OH)2 диссоциирует так:
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у, где у — кислотность основания.
Составим уравнения электролитической диссоциации слабого двухкислотного основания — гидроксида железа (II) Fe(OH)2.
Первая ступень диссоциации (отщепляется один гидроксид-ион ОН — ):
Вторая ступень диссоциации (отщепляется гидроксид-ион ОН — от сложного катиона FeOH + ):
Основания имеют некоторые общие свойства. Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН — .
Каждая ступень диссоциации слабых многоосновных кислот и слабых многокислотных оснований характеризуется определенной константой диссоциации: K1, K2, K3, причем K1 > K2 > K3. Это объясняется тем, что энергия, которая необходима для отрыва иона Н + или ОН — от нейтральной молекулы кислоты или основания, минимальна. При диссоциации по следующей ступени энергия увеличивается, потому что отрыв ионов происходит от противоположно заряженных частиц.
Амфотерные гидроксиды могут реагировать и с кислотами, и с основаниями. Теория электролитической диссоциации объясняет двойственные свойства амфотерных гидроксидов.
Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н + и гидроксид-анионы ОН — , т. е. диссоциируют по типу кислоты и по типу основания.
К амфотерным гидроксидам относятся Ве(ОН)2, Zn(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3 и другие. Амфотерным электролитом является также вода Н2O.
В амфотерных гидроксидах диссоциация по типу кислот и по типу оснований происходит потому, что прочность химических связей между атомами металла и кислорода (Ме—О) и между атомами кислорода и водорода (О—Н) почти одинаковая. Поэтому в водном растворе эти связи разрываются одновременно, и амфотерные гидроксиды при диссоциации образуют катионы Н + и анионы ОН — .
Составим уравнение электролитической диссоциации гидроксида цинка Zn(OH)2 без учета ее ступенчатого характера:
Нормальные соли — сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
Составим уравнения электролитической диссоциации нормальных солей: а) карбоната калия K2CO3, б) сульфата алюминия Al2(SO4)3:
Кислые соли — сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.
Составим уравнения электролитической диссоциации кислой соли гидрокарбоната натрия NaHCО3.
Сложный анион НСО3 — (гидрокарбонат-ион) частично диссоциирует по уравнению:
Основные соли — электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы состоящие из атомов металла и гидроксогрупп ОН — .
Составим уравнение электролитической диссоциации основной соли Fe(OH)2Cl — дигидроксохлорида железа (III):
Сложный катион частично диссоциирует по уравнениям:
Для обеих ступеней диссоциации Fe(OH)2 + .
Источник
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Источник
Химик.ПРО – решение задач по химии бесплатно
Константа диссоциации азотистой кислоты (HNO2) составляет 5 ∙ 10 -4 . Вычислить степень диссоциации (α) и равновесную концентрацию ионов водорода ([H + ]) для 0,05 раствора этой кислоты.
I способ решения (II способ)
Запишем уравнение диссоциации азотистой кислоты:
Данную задачу я предлагаю решать через закон разбавления Оствальда в его приближенном варианте, используя формулу:
α – степень диссоциации;
K – константа диссоциации;
C– общая концентрация электролита.
Хочу обратить ваше внимание на то, что данная формула может быть использована для вычисления степени диссоциации (α ) и равновесной концентрации ионов водорода [H + ] лишь при условии, что концентрация слабого электролита в 100 или более раз больше его константы диссоциации (K). В решенной задаче отношение C / K = 100.
Константа диссоциации характеризует способность электролита диссоциировать на ионы.
Найдем степень диссоциации азотистой кислоты, подставив известные значения из условия задачи в формулу:
что соответствует 10 %.
Найдем равновесную концентрацию ионов водорода:
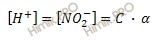
[H + ] = 0,05 ∙ 0,1 = 0,005 (моль/л).
Ответ: степень диссоциации азотистой кислоты = 10 %; равновесная концентрация ионов водорода = 0,005 моль/л.
Источник
Химик.ПРО – решение задач по химии бесплатно
Константа диссоциации азотистой кислоты (HNO2) составляет 5 ∙ 10 -4 . Вычислить степень диссоциации (α) и равновесную концентрацию ионов водорода ([H + ]) для 0,05 раствора этой кислоты.
I способ решения (II способ)
Запишем уравнение диссоциации азотистой кислоты:
Данную задачу я предлагаю решать через закон разбавления Оствальда в его приближенном варианте, используя формулу:
α – степень диссоциации;
K – константа диссоциации;
C– общая концентрация электролита.
Хочу обратить ваше внимание на то, что данная формула может быть использована для вычисления степени диссоциации (α ) и равновесной концентрации ионов водорода [H + ] лишь при условии, что концентрация слабого электролита в 100 или более раз больше его константы диссоциации (K). В решенной задаче отношение C / K = 100.
Константа диссоциации характеризует способность электролита диссоциировать на ионы.
Найдем степень диссоциации азотистой кислоты, подставив известные значения из условия задачи в формулу:
что соответствует 10 %.
Найдем равновесную концентрацию ионов водорода:
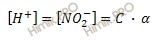
[H + ] = 0,05 ∙ 0,1 = 0,005 (моль/л).
Ответ: степень диссоциации азотистой кислоты = 10 %; равновесная концентрация ионов водорода = 0,005 моль/л.
Источник
Химические свойства
азотной кислоты в свете теории
электролитической диссоциации
Урок по данной теме рекомендуется проводить в рамках аттестации, при проведении методического объединения учителей либо как конкурсный в 9-м классе в учебном заведении любого типа – от простой средней общеобразовательной школы до лицея или гимназии. Материал подобран и скомпонован так, что не потребует каких-либо изменений при изучении этой темы на уроке вне зависимости от того, по каким учебникам преподается химическая дисциплина в данной конкретной школе. Четко поставленные цели, задачи, список необходимых к уроку реактивов и химической посуды позволят учителю, особенно начинающему, провести интересный урок, а учащиеся получат настоящий учебный праздник и прочные знания по отнюдь не легкому предмету – химии. Материал данного урока можно рассматривать как изучение нового материала при прохождении большой темы «Азот и его соединения».
Отличительная особенность данного урока заключается в том, что в процессе изучения нового материала значительное количество времени уделяется повторению и закреплению по темам «Реакции ионного обмена и условия их протекания до конца» и «Теория электролитической диссоциации». В качестве повторения именно эти темы школьного курса химии были выбраны автором не случайно. Во-первых, именно с этими ранее изученными темами прочно связан новый материал «Химические свойства азотной кислоты». Во-вторых, эти темы достаточно сложные, и для лучшего усвоения учащимися именно они требуют многократного повторения на уроках. В-третьих, материал этих тем часто включается в варианты заданий областных контрольных работ, тестовых заданий различного уровня тестирования.
Данному уроку предшествует знакомство с азотом, аммиаком, солями аммония. Вместе с тем изучением химических свойств азотной кислоты тема «Азот и его соединения» не заканчивается. Рекомендуется провести еще один урок по изучению особых свойств азотной кислоты. На этом уроке рассмотреть способность HNO3 реагировать с металлами, стоящими в ряду напряжений металлов до и после водорода по разным схемам, в зависимости от активности металла и концентрации кислоты, а также обсудить качественную реакцию на азотную кислоту, взаимодействие азотной кислоты с белком (ксантопротеиновая реакция) и окисление концентрированной азотной кислотой органических соединений (скипидара, бензина, целлюлозы). Такая раскладка изучаемого материала позволит творчески работающему учителю на следующем уроке выявить степень усвоения данного материала. Логическим завершением темы явится проверочная или контрольная работа по всему изученному материалу.
Тип урока. Урок усвоения новых знаний.
Форма урока. Урок-лекция.
Цели. Изучить химические свойства азотной кислоты (реакции, протекающие в растворах). Повторить материал о реакциях ионного обмена и условиях их протекания до конца, опираясь на теорию электролитической диссоциации. Развить познавательный интерес учащихся к химической науке. Формировать всесторонне развитую, гармоничную личность. Закрепить навыки работы с лабораторным оборудованием и правила проведения лабораторного демонстрационного эксперимента.
Оборудование и реактивы. Штатив с пробирками, асбестовые сетки, штатив для демонстрационных пробирок, демонстрационные пробирки или химические стаканы (10 шт.), спиртовка, спички, пробиркодержатель; медные опилки, оксид меди(II), растворы азотной кислоты, хлорида железа(III), гидроксида натрия или калия, карбоната натрия (или кусочек мрамора), индикаторов – фенолфталеина, лакмуса и метилового оранжевого (в специальной посуде), нитратов калия, натрия и бария, магниевые опилки, роданид калия или аммония, порошок сухого горючего, дихромат аммония.
После изучения материала учащиеся должны знать:
• химические свойства азотной кислоты в свете теории электролитической диссоциации (кроме особых свойств);
• признаки протекания реакций ионного обмена до конца;
• что такое электролит и каковы его отличия от неэлектролита;
• писать уравнения реакций с участием азотной кислоты в молекулярном, полном и сокращенном ионном видах;
• определять по внешним признакам, протекает ли данная химическая реакция до конца;
• грамотно работать с лабораторным оборудованием.
План фронтальной работы с классом
1. Определение темы урока.
2. Выявление цели урока.
3. Изложение материала в форме лекции.
В силу достаточно большого объема, громоздкости материала рекомендуется по возможности отводить на изучение темы урока 50 мин учебного времени, причем начать урок следует не с проверки заданного к уроку домашнего задания (если таковое было), а с определения темы и непосредственного изложения нового материала в лекционной форме.
Начинается урок с занимательной минутки – демонстрации опытов «Вулканчик», «Бенгальские огни» (желтый, фиолетовый и зеленый), «Искусственная кровь». Учитель акцентирует внимание учащихся на том, что во всех проведенных опытах фигурируют соединения азота.
Определение цели урока проводится совместно с учащимися по следующей логической схеме: изучены азот N2, его бинарное соединение аммиак NH3, соли аммония, следовательно, предстоит изучать азотную кислоту и ее свойства. Учитель уточняет, что будут рассмотрены свойства раствора азотной кислоты, говорит о демонстрационном лабораторном эксперименте, который ждет учащихся на уроке.
Все рассматриваемые реакции азотной кислоты записываются на доске. По ходу урока учитель повторяет с учащимися, что реакции ионного обмена протекают до конца, если в результате реакции выделяется газ, образуется малодиссоциирующее вещество вода или получается не растворимое в воде соединение.

1. Азотная кислота изменяет окраску индикаторов:
НNO3 + лакмус фиолетовый 
НNO3 + метиловый оранжевый 
В силу сложности формул индикаторов данные взаимодействия отражают схемой, а не уравнением.
2. Взаимодействие азотной кислоты с металлами, стоящими в ряду активности после водорода:
Сu + 4НNO3 = Сu(NO3)2 + 2Н2О + 2NO2
Выделяющийся газ NO2 ядовит, поэтому необходимо проводить опыт в вытяжном шкафу. Чтобы реакция началась быстрее, раствор азотной кислоты можно подогреть.
Уравнение реакции записывают в полном и сокращенном ионном видах:
Сu 0 + 4Н + + 4NO3 – = Сu 2+ + 2NO3 – + 2Н2О + 2NO2
(полное ионное уравнение),
Сu 0 + 4Н + + 2NO3 – = Сu 2+ + 2Н2О + 2NO2
(сокращенное ионное уравнение).
Учитель напоминает правила записи уравнений реакций в полном и сокращенном ионном видах.
В растворе на ионы не распадаются оксиды, газы, вода, соединения, обозначенные в таблице растворимости буквами «Н» и «М». С зарядом 0 записываются металлы и неметаллы в свободном виде, вступающие в реакции или образующиеся в результате химической реакции.
3. Взаимодействие азотной кислоты с основными оксидами:
(полное ионное уравнение),
СuО + 2Н + = Сu 2+ + 2Н2О
(сокращенное ионное уравнение).
4. Взаимодействие азотной кислоты с основаниями.
Непосредственно перед опытом получают гидроксид железа(III) по уравнению реакции:
FeCl3 + 3КОН = 3КСl + Fe(ОН)3
Затем действием азотной кислоты растворяют осадок Fe(OH)3:
(полное ионное уравнение),
(сокращенное ионное уравнение).
5. Взаимодействие азотной кислоты с солями, образованными более слабыми и летучими кислотами:
СаСО3 + 2НNO3 = Са(NO3)2 + 2Н2О + СО2
СаСО3 + 2Н + + 2NO3 – = Са 2+ + 2NO3 – + 2Н2О + СО2
(полное ионное уравнение),
СаСО3 + 2Н + = Са 2+ + 2Н2О + СО2
(сокращенное ионное уравнение).
Таким образом, химические свойства азотной кислоты изучены. После этого ученики называют три признака протекания реакций ионного обмена до конца.
Отличившиеся на уроке получают оценки, учитель обосновывает, почему он ставит ту или иную оценку ученику.
Домашнее задание. По учебнику О.С. Габриеляна «Химия-9» (М.: Просвещение, 2000) § 26; записи в тетради. В конце урока учитель раздает карточки с тестовыми заданиями трех уровней сложности (на оценки «5», «4» или «3», в зависимости от способностей учащегося и по его желанию) на повторение уже изученного материала по теме «Азот и его соединения». Это письменное домашнее задание.
Если в конце урока остается время, то учащиеся начинают работу с карточками. Первые трое, правильно ответившие на вопросы тестов, получают оценку «5» с занесением в журнал.

В а р и а н т 1 (на оценку «5»)
1. Азотную кислоту можно получить но схеме:
а) NO2 + O2 + H2O 
б) NaNO3 + HCl 
в) NO + H2O 
г) NH3 + H2O 
2. При каталитическом окислении аммиака кислородом воздуха помимо воды образуется:
а) азот; б) аммиак;
в) оксид азота(IV); г) оксид азота(II).
3. Межмолекулярная химическая связь, возникающая между атомами водорода и атомами сильно электроотрицательных элементов (фтора, кислорода, азота), называется:
а) металлической; б) водородной;
в) ковалентной; г) атомной.
4. Степень окисления атома азота в катионе аммония равна:
а) –3; б) +5; в) +3; г) 0.
5. Лабораторный способ получения аммиака:
а) Сa(OH)2 + NH4Cl 
б) NH4ОН 
в) NH4NO3 + HCl 
г) NH4ОН + H3PO4 
6. Какая из солей аммония широко используется в хлебопечении?
а) Силикат; б) сульфат; в) нитрат; г) карбонат.
7. Несолеобразующим азотсодержащем оксидом является:
8. Разбавленная азотная кислота без нагревания не взаимодействует с:
а) медью; б) барием; в) калием; г) литием.
9. Концентрированная азотная кислота без нагревания не взаимодействует с:
а) калием; б) медью; в) железом; г) рубидием.
10. Составная часть ляписа:
а) нитрат серебра; б) нитрат калия;
в) нитрат алюминия; г) верного ответа нет.
В а р и а н т 2 (на оценку «4»).
1. Чилийская селитра – это:
а) нитрат бария; б) нитрат натрия;
в) нитрат кальция; г) нитрат алюминия.
2. При некаталитическом окислении аммиака кислородом воздуха помимо воды образуется:
а) азот; б) нитрат аммония;
в) азотная кислота; г) гидразин.
3. Формула катиона аммония:
4. Валентность атома азота в катионе аммония равна:
а) I; б) III; в) VI; г) IV.
5. Второе название хлорида аммония:
а) поташ; б) селитра; в) нашатырь; г) купорос.
6. Формула аммиачной селитры:
7. При взаимодействии оксида азота(IV) с водой образуются:
а) азотная и азотистая кислоты;
б) аммиак и гидразин;
в) аммиак и гидразон;
г) гидроксид аммония.
8. Бурый газ (оксид азота) имеет формулу:
9. С порошкообразной серой при нагревании может взаимодействовать:
а) угольная кислота; б) азотная кислота;
в) соляная кислота; г) кремниевая кислота.
10. При разложении нитратов помимо прочих продуктов выделяется:
а) азот; б) хлор; в) водород; г) кислород.
В а р и а н т 3 (на оценку «3»)
1. Степень окисления азота –3 реализуется в соединении:
2. При обычных условиях азот реагирует только с:
а) железом; б) оловом; в) барием; г) литием.
3. Аммонал – это смесь аммиачной селитры с порошкообразными:
а) фосфором и кремнием;
б) алюминием и углем;
в) железом и серой;
г) медью и бором.
4. Самой сильной кислотой из приведенных является:
а) угольная; б) сернистая;
в) азотная; г) сероводородная.
5. Реакцией ионного обмена не является взаимодействие:
а) азота с магнием;
б) азотной кислоты с гидроксидом натрия;
в) карбоната натрия с азотной кислотой;
г) оксида калия с азотной кислотой.
6. Оксид азота(IV) выделится в качестве продукта реакции:
а) азотной кислоты с карбонатом кальция;
б) концентрированной азотной кислоты с медью;
в) разбавленной азотной кислоты с гидроксидом аммония;
г) азотной кислоты с оксидом магния.
7. Азотная кислота не реагирует с:
в) оксидом алюминия;
г) угольной кислотой.
Ответы на тестовые задания
В а р и а н т 1. 1 – а, 2 – г, 3 – б, 4 – а, 5 – а, 6 – г, 7 – в, 8 – а, 9 – в, 10 – а.
В а р и а н т 2. 1 – б, 2 – а, 3 – в, 4 – г, 5 – в, 6 – г, 7 – а, 8 – б, 9 – б, 10 – г.
В а р и а н т 3. 1 – в, 2 – г, 3 – б, 4 – в, 5 – а, 6 – б, 7 – г.
Л и т е р а т у р а
Габриелян О.С. Химия-8. М.: Дрофа, 2000; Габриелян О.С. Химия-9. М.: Дрофа, 2000; Фельдман Ф.Г., Рудзитис Г.Е. Химия-9. М.: Просвещение, 1990; Гузей Л.С., Кузнецов В.Н., Гузей А.С. Общая химия. М.: Изд-во МГУ, 1999; Бабков А.В., Попков, В.А. Общая и неорганическая химия. М.: Изд-во МГУ, 1998; Глинка Н.Л. Общая химия. Л.: Химия, 1988.
Источник